Velocidad de las reacciones químicas, factores que la afectan y su importancia
Es muy bien conocido que hay reacciones que ocurren rápidamente, es decir que los productos se forman al transcurrir poco tiempo de iniciada, tal es el caso de una explosión que ocurre casi instantáneamente, mientras que otras son muy lentas como la oxidación del hierro por el aire. Esa diferencia se debe a que la velocidad depende de varios factores que pueden afectarla y hacerla más rápida o más lenta, entre ellos se encuentran la temperatura, superficie de contacto entre las especies reaccionantes, catalizadores y la concentración.
En este post, hoy les quiero mostrar algunos procesos químicos sencillos, en donde se pone de manifiesto la influencia de estos factores de forma cualitativa, les invito a observar cada una de las siguientes imágenes e intentar identificar que factor fue estudiado en cada caso.

Fuente: propia
Análisis de los factores
Influencia de la superficie de contacto entre los reactivos
Para el estudio de este factor, se trabajó con
• Bicarbonato de sodio (NaHCO3)
• Agua (H2O)
• Vasos precipitados
El procedimiento consistió en tomar dos vasos precipitados, al de la izquierda (imagen 1) se le agregó el bicarbonato en pastilla mientras que al de la derecha se le adicionó la misma cantidad de bicarbonato pulverizado. Obteniéndose el siguiente resultado:

Fuente: propia
Como se puede observar, dependiendo de las características físicas y químicas de las especies que reaccionen dependerá la velocidad a la cual transcurra la reacción. Así, en el caso del bicarbonato al adicionarlo en agua, la reacción se lleva a cabo más rápidamente cuando el sólido se encuentra pulverizado, ya que en esta forma hay mayor superficie de contacto entre los reactivos y la reacción es más rápida.
Este factor también explica porque los trozos de madera y carbón arden más despacio en comparación que si los mismos se pulverizan, ya que el contacto con el oxígeno en este caso es mayor.
Influencia del Catalizador
En este caso se trabajó con
• Peróxido de hidrógeno (agua oxigenada, H2O2)
• Catalizador ( catalasa contenida en un trozo de papa)
• Vasos precipitados
El procedimiento consistió en tomar dos vasos precipitados, al de la izquierda (imagen 2) se le adicionó peróxido de hidrógeno, mientras que al de la derecha se le adicionó peróxido de hidrógeno y un trozo de papa. Obteniéndose el siguiente resultado:

Fuente: propia.
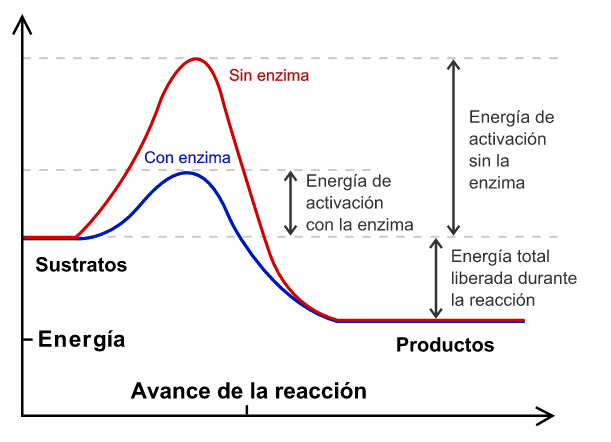
Como se puede observar el factor que diferencia ambos tratamientos es la presencia del Catalizador, siendo éste una sustancia que cambia la velocidad de una reacción. En su mayoría es usado para aumentar la velocidad de la reacción, se recupera al final y no sufre cambios, proporcionando un camino alternativo donde se necesita una energía de activación más baja que la requerida en el camino original para lograr la transformación de los reactivos a productos. En pocas ocasiones también se emplean para retardar la velocidad de una reacción determinada.
Fuente: Kes47(2010), imagen de dominio público
El peróxido de hidrógeno es relativamente estable, sin embargo cualquier partícula externa puede descomponerlo, en este caso se empleó una pequeña cantidad papa, la cual contiene catalasa, que es una enzima que actúa acelerando la descomposición del peróxido de hidrógeno en agua y oxígeno. Esto sucede ya que sobre la superficie del sólido que actúa como catalizador se adsorben los reactivos en determinadas orientaciones que originan mayores colisiones que en las que se producen en ausencia de él.
Este factor explica el hecho de que pequeñas cantidades de compuestos de clorofluorocarbonos producen efectos tan graves en la capa de ozono, ya que ellos se descomponen en radicales libres y catalizan la destrucción del ozono.
Influencia de la Temperatura
Los materiales y reactivos empleados fueron
• Magnesio (Mg)
• Agua ( H2O)
• Indicador (fenolftaleína)
• Vasos precipitados
El procedimiento consistió en tomar dos vasos precipitados, al de la izquierda (imagen 3) se le adicionó el magnesio en trozos en agua fría, mientras que al de la derecha se le adicionó la misma cantidad de magnesio en trozos en agua caliente. Al transcurrir el tiempo se le agregó el indicador para mostrar la presencia de una solución alcalina al llevarse a cabo una reacción de desplazamiento entre el magnesio y el agua. Obteniéndose el siguiente resultado:

Fuente: propia
Cualitativamente se puede observar que en la reacción la temperatura tiene un efecto directamente proporcional a la velocidad de la reacción. Las reacciones se aceleran a medida que la temperatura se eleva. Esto se debe a que a una baja temperatura solo una parte de las moléculas de reactivo poseen la energía necesaria para reaccionar y por medio de las colisiones formar los productos. Sin embargo, a medida que la temperatura es mayor, aumentara la energía cinética de las moléculas y con ello la probabilidad de colisiones con la energía de activación necesaria para reaccionar, haciendo por ende que la reacción sea más rápida. Por lo que en el vaso de la derecha se observa mayor coloración en el mismo tiempo por la presencia de mayor cantidad del hidróxido formado.
Este factor explica por qué en los hogares se cocinan los alimentos, ya que el aumento de la temperatura contribuye a la ruptura de las paredes celulares y a la descomposición de las proteínas presentes en ellos. Mientras que una disminución retarda la reacción de descomposición, por lo que los congelamos.
Influencia de la Concentración de los reactivos
Materiales y reactivos empleados
• Ácido acético 5% (Vinagre comercial)
• Bicarbonato de sodio (NaHCO3)
El procedimiento consistió en tomar dos vasos precipitados, al de la izquierda (imagen 4) se le adicionó 50 mL de vinagre, mientras que al de la derecha se le adicionó aproximadamente 10 mL de vinagre y 40 mL de agua, esto para lograr una solución de menor concentración. En ambos vasos se le adicionó una pequeña cantidad de bicarbonato. Obteniéndose el siguiente resultado:

Fuente: propia
En este caso, la reacción se ve influenciada por la concentración de los reactivos. A medida que aumenta la concentración de los reactivos aumenta la velocidad de la reacción, esto permite que existan mayor número de moléculas de reactivo que choquen y reaccionen acelerando la velocidad. Es por ello que se observa, que en el vaso precipitado de la derecha ocurrió más lenta y el bicarbonato no reaccionó completamente en el mismo tiempo.
Fuente: propia
Con la información presentada, se resalta la importancia del conocimiento de los factores de los cuales dependen las reacciones químicas. Ya que a nivel de laboratorio, doméstico e industrial se pueden controlar y así lograr los objetivos propuestos.
Referencias Bibliográficas
Atkins, P., y Jones L. (2006). Principios de Química. 3era edición
Whitten K., y Gailey K., (1985). Química General
¡Felicitaciones!
Estas participando para optar a la mención especial, que se efectuará el 22 de Julio del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Congratulations @yusvelasquez! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
SteemitBoard World Cup Contest - The results, the winners and the prizes
Hi @yusvelasquez!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV