GASES (Fenómenos, propiedades y características)

Gases referenciales
Propiedades
En nuestro día a día, estamos rodeados de aire y éste es una mezcla de gases que contiene nitrógeno molecular, oxígeno molecular, argón e hidrógeno en proporciones mayores, y debido a los altos niveles de contaminación contiene en menores cantidades dióxido de carbono, monóxido de carbono, dióxido de azufre gas metano entre otros contaminantes gaseosos que se mezclan con el aire. Entonces como conocemos que estamos rodeados de un gas se puede llegar a unas sencillas conclusiones de sus propiedades por experiencias propias.
• Es posible distinguir a través de un gas, es decir, suelen ser transparentes. (Aunque se sabemos que los humos de los automóviles suele ser de color blanco o gris, también es posible observar a través de ellos.
• Los gases pueden ser comprensibles, es decir, puede obligarse a una cantidad grande de gas a ocupar un recipiente o un contenedor de menor tamaño. Como por ejemplo, se puede tomar aire del ambiente por medio de una bomba hidráulica e introducirlo en un cacho de bicicleta o de motocicleta y el gas se adecuará al nuevo compartimiento.
• Y por supuesto puede ocurrir lo contrario, los gases pueden expandirse sin límite alguno. Es decir, cuanto más grande el recipiente más pueden separarse las moléculas que componen un gas para ocuparlo por completo. Entonces es correcto decir que el volumen de un gas, es el volumen del recipiente contenedor de este.
• Los gases sin necesidad de ayuda, pueden mezclarse rápidamente. Pueden visualizarlo en el mismo ejemplo del vapor emitido por los carros, que al principio de su salida se muestra de color más obscuro pero al cabo de unos minutos se difunde con el aire, se disipa y vuelve imperceptible.
• Todo gas hace presión (Empuja) a las paredes de su contenedor, debido a los múltiples choques de las moléculas del gas. Un ejemplo perfecto son las bolsas de aires que se llena al ocurrir la colisión de los automóviles, para crear un soporte entre la persona y el tablero y así disminuir el riesgo mortal.
• Por último, los gases tiene la propiedad de dilatarse con velozmente cuando se calientan. Por ello cuando ocurren explosiones es por la rápida expansión de los gases por el calor del medio.
Ahora con el desarrollo de la teoría de los gases se pueden explicar cada uno de los 6 fenómenos que se describieron acá arriba.
Presión de los Gases
En el siglo 17 comenzaron los científicos a experimentar sobre las presiones. El físico y matemático italiano Evangelista Torricelli, desarrollo una serie de experimentos que involucraba un tubo de vidrio de 90 cm y mercurio. El tubo lo llenó con mercurio y selló uno de sus extremos, y con el dedo tapó el segundo extremo y luego lo invirtió en un beacker con mercurio, de manera que el lado abierto quedó dentro del líquido. Como se observa en la figura siguiente.
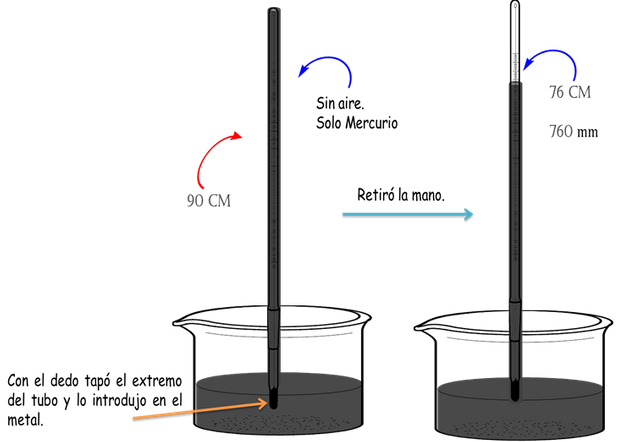
Experimento de Torricelli- Fuente: @VianniS
Al retirar el dedo, el mercurio no se escapó del tubo, como estaba esperando Torricelli. En cambio solo unos cuantos centímetros descendió el líquido. La altura h desde la superficie del mercurio en todos los experimentos fue de 76 cm. Esto llevo a preguntarse ¿Por qué no bajaba todo el mercurio? O ¿Qué gas se encontraba en el espacio vacío del tubo?
La cantidad de metal dentro del tubo tiene una masa precisada y por ende ejercen una presión hacia abajo. Cuando el tubo era retirado del mercurio este descendía rápidamente si no se colocaba el dedo. Entonces esto llevó a la conclusión de que el mercurio del recipiente estaba ejerciendo una presión sobre el mercurio del tubo para que este no se saliera. Para llegar a esto, pasaron años de investigación, ya que la presión descendiente del líquido del tubo se balancea con la presión atmosférica sobre el mercurio del recipiente. Este fenómeno pueden observarlo en la figura de abajo.
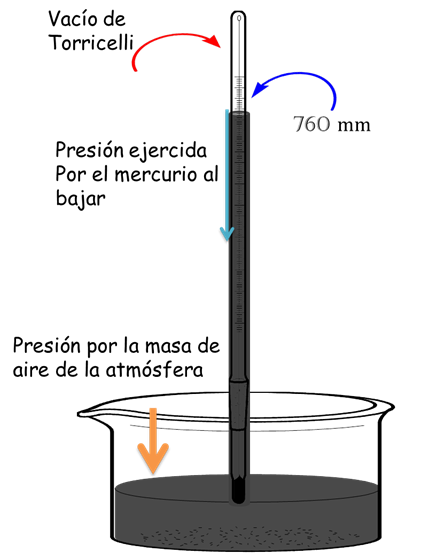
Balanceo de las presiones del mercurio con la atmosférica- Fuente: @VianniS
La atmósfera no es más que aire que rodea el planeta tierra y ejerce una presión sobre ella, y posee una densidad especifica que disminuye con la altura de la capa. Entonces, podemos definir la presión como la fuerza de empuje por unidad de área específica. Es decir que P= peso/área. Y por lo tanto sus unidades son gramos por centímetros cuadrados. Para entenderlo mejor se muestra la figura 4. Donde se observa una lámina de cualquier metal de 2 kilogramos de peso. En la parte a la barra está posada en un área de 4 cm2, por lo que la presión ejercida es de 2 Kg/4 Cm2 o 0,5 Kg/cm2. En la parte b la masa de la lámina reposa sobre 50 cm2 por lo que la presión ejercida es 2 Kg/50cm2 o 0,04 Kg/cm2 Es decir, que al aumentar el área de reposo por un factor de 50 la presión se reduce en ese mismo factor. Y por supuesto ocurre lo contrario si se disminuye el área de contacto la presión aumentará de manera lineal.
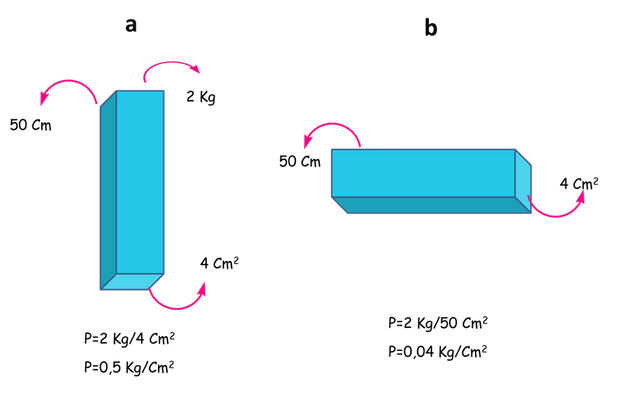
Fuerza por unidad de área - Fuente: @VianniS
Es por ello que en el tubo de Torricelli, la presión que es aplicada por el mercurio del tubo por unidad de área es equivalente a la presión externa que es producto de la fuerza ejercida por la masa del aire de la atmósfera por el área del recipiente con el mercurio. El equipo empleado por Torricelli aún se utiliza y lo conocemos como el barómetro. Este equipo es empleado para predecir en muchos casos los cambios climáticos debido a que con el clima cambia la presión atmosférica.
Con esto se inician las medidas de las presiones de los gases. Ya que la presión producida en una columna de mercurio fue de 76 cm de altura o 760 mm a 0 °C esto es conocido como atmósfera estándar. Por otro lado, 1/760 de una atmósfera estándar recibe la denominación de torr por los descubrimientos de Torricelli. 760mmHgm=760 torr.
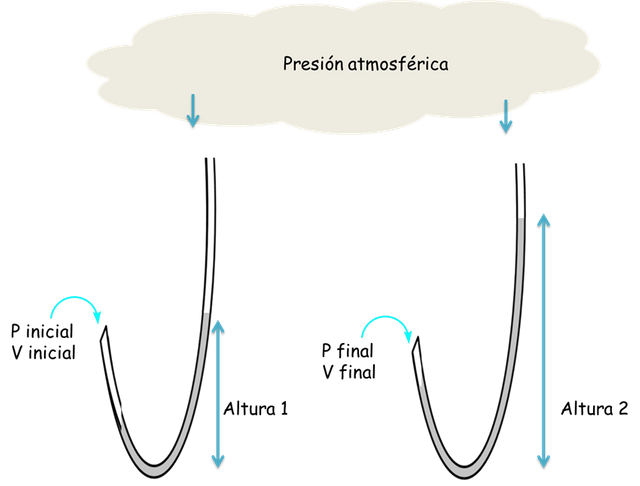
Muestra de aire atrapada en un tubo con mercurio - Fuente: @VianniS
En los laboratorios de química experimental se utiliza una herramienta que cumple la función del barómetro pero se denomina manómetro para pedir las presiones de los gases. Este consiste en un tubo en forma de U que se llena parcialmente de mercurio o agua. Los dos extremos deben estar abiertos para comparar las presiones. Cuando el líquido está en el mismo nivel y ambos lados del tubo quiere decir que las presiones de las muestras gaseosas son las mismas. Caso contrario ocurre si los niveles del líquido son distintas en ambos brazos es porque las presiones de los gases son distintas. Y la diferencia de altura representa la diferencia entre las presiones.
Relación Presión-Volumen de los Gases.
En los años 166… un químico y físico irlandés llamado Robert Boyle describió una nueva serie de experimentos para estudiar la naturaleza del aire y el vacío basándose en su antecesor Torricelli. Este científico empleó un tubo de vidrio en forma de J lleno de mercurio como se muestra en la figura de abajo. Un solo extremo se encontraba cerrado atrapando así una cantidad de aire. Por el lado abierto introdujo cantidades del metal líquido y anotaba la altura o el volumen del aire atrapado entre el mercurio y el extremo cerrado. Esta diferencia entre las alturas es la presión del aire atrapado. Como conclusión Boyle desarrolla la ley que lleva su nombre que relaciona la presión y el volumen. Al incrementar la presión P, el volumen disminuye, es decir que la disminución del volumen es inversamente proporcional al aumento de la presión. Esto es fácilmente observable en el gif de un pistón.

Ley de Boyle - Fuente: @VianniS
Relación Volumen-Temperatura de los Gases
Boyle realizó algunas observaciones de la temperatura sobre las presiones y volúmenes de los gases, sin embargo nada fue formalizado hasta 1787 cuando Jacques Charles un científico francés estudió los fenómenos que producía los cambio de temperatura en el volumen de un gas. Estos experimentos se realizaron colocando un tubo con una cantidad pequeña de mercurio y cerrado por un extremo y encerrando una cantidad de aire como una especie de pistón sumergido en un beacker con agua. Al subir la temperatura del agua aumentaba el volumen del gas la presión del sistema estuvo constante en todo el proceso. Con estos resultados Charles describe la conocida ley de Charles: ésta recita que a cualquier presión constante al aumentar la temperatura de un gas su volumen aumentará de manera directamente proporcional Ver Figura siguiente
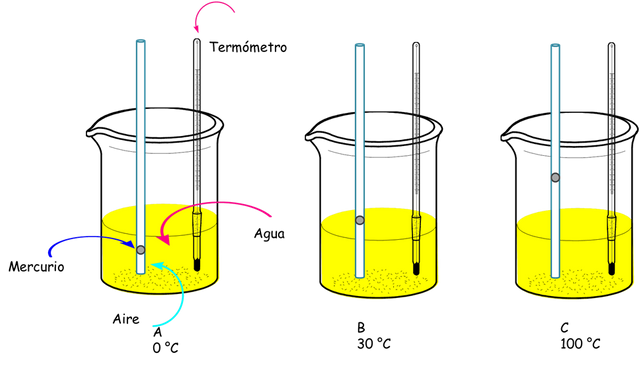
Ley de Charles - Fuente: @VianniS
De estos experimentos Charles encontró una serie de resultados que llamaron su atención. Por cada grado Celsius que aumentaba de temperatura el mercurio se elevaba para aumentar la cantidad del gas presente en 1/273 de su volumen inicial todo a la presión atmosférica y si el gas era enfriado disminuía 1/273 de su volumen por cada grado que bajaba. Los experimentos continuaron hasta que unos años después que Lord Kelvin desarrolla la escala Kelvin de temperatura donde relaciona los grados Celsius con el cero absoluto de temperatura a 273,15 K que establece que a esta temperatura el volumen de cualquier gas es cero en el cero absoluto.
Ley combinada de los Gases
La ley de Boyle y la ley de Charles se relacionan y se obtiene la ley combinada de los gases que establece la relación entre la Temperatura T, la Presión P y el Volumen V de un gas determinado.
Donde el volumen es inversamente proporcional a la presión y directamente proporcional a la temperatura.
Ley de Dalton (Presiones parciales de los gases)
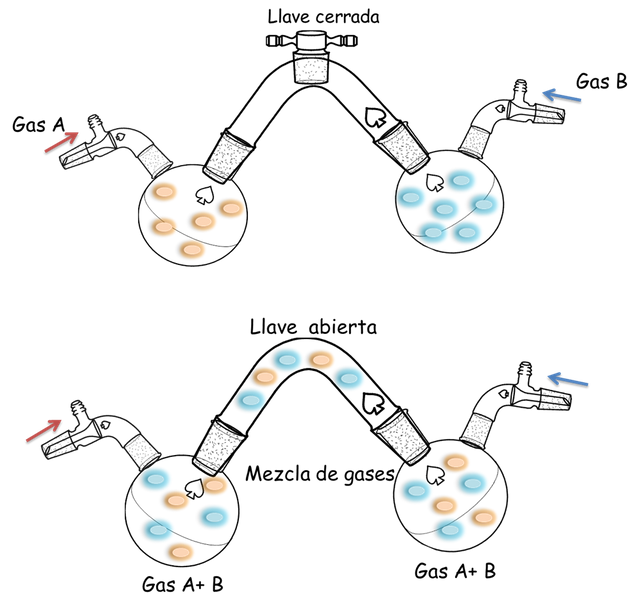
Hasta este momento les he definido lo que es la presión de un gas, es decir la fuerza que ejercen los gases sobres las paredes de un recipiente o sobre un líquido. Ahora ¿Qué sucedería con la presión, si existiera más de un gas presente? ¿Qué consecuencia tendrá la presión? Éstas interrogantes se pueden responder observando las figuras que a continuación les presento:
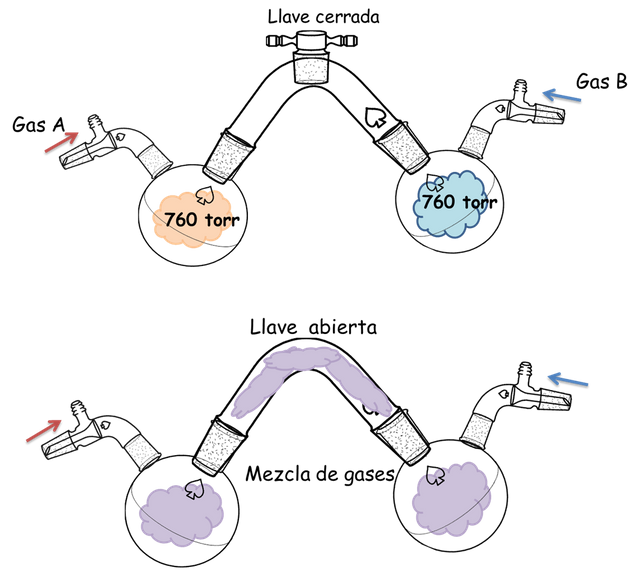
Presiones parciales.- Fuente: @VianniS
En la parte A se encuentran dos (2) balones unidos por un tubo y una llave de paso cerrada, cada balón contiene un gas distinto a 760 torr de presión, si la llave es abierta y los gases se mezclan no se observará cambio en la presión aun cuando el volumen de los gases aumenta al doble, esto se debe a que cuando un gas es dilatado hasta el doble de su volumen inicial su presión baja a la mitad de la presión inicial- En la figura cada balón es de 2 litros por lo que el gas se dilata hasta 4 litros al abrir la llave, de manera que la presión disminuye de 760 torr a 380 torr. La Ley de las Presiones Parciales de Dalton establece que la presión total de un sistema de gases es la sumatoria de las presiones parciales de cada gas.
Por lo que, en nuestro ejemplo la presión total es igual a 380 torr + 380 torr que resulta en 760 torr. Este fenómeno tiene mucha relevancia cuando se quieren saber las presiones de gases en contacto con líquidos, debido a que éstos tienden a evaporarse contribuyendo con la presión total en estos sistemas.
Ley de Graham
Esta ley discute sobre la difusión de los gases en la atmósfera entre sí, esto con diferentes grados de rapidez o facilidad. Para llegar a ésta conclusión, en 1.830 el científico Tomas Graham permitió la transferencia de gases a través de un tubo estrecho con diferentes velocidades encontrando que, el hidrógeno es difundido mucho más rápido que el oxígeno debido a que su densidad es mayor, en otras palabras mientras más baja es la densidad de un gas, su velocidad de difusión es mayor.
Teoría Cinética de los Gases
Todo lo discutido hasta este punto puede ser explicado por la teoría cinética de los gases, que se desarrolló en el transcurso de 120 años, desde 1.738 hasta 1.857 por Bernoulli, Boltzman, Maxwell y Clausius; y se puede resumir en estos cuatro puntos:
- Los gases están formados por moléculas muy separadas, invisibles e imposibles de comprimir, pueden ser pesados, sin embargo no se puede medir su volumen individual, es por ello la baja densidad que poseen los gases en condiciones ordinarias. El volumen de un gas es el volumen del recipiente, gracias a esta cualidad.
- Las partículas que componen los gases se encuentran siempre en movimiento y colisionando entre sí y con las paredes del contenedor, gracias a éstos constantes movimientos las moléculas gaseosas poseen energía cinética.
- Las moléculas gaseosas no se atraen, ni se repelen. Existe transferencia de energía en la colisiones pero esta no se pierde.
- Las partículas gaseosas no tienen la misma velocidad, por ende no poseen la misma energía.
Difusión de gases.- Fuente: @VianniS
Esta teoría explica las leyes por las cuales se rigen los gases. Ya definimos la presión como una fuerza que es ejercida sobre un área específica. Es por ello que en los gases la presión es provocada por las partículas cuando colisionan con las paredes del contenedor y por ende mientras más moléculas se encuentren presente ejerciendo múltiples choques mayor será la presión. Los movimientos de las moléculas en estado gaseoso son totalmente caóticos, es decir, ocurren de manera aleatoria.
Velocidad de las moléculas gaseosas
Cuando existe una temperatura fija y determinada la energía cinética de las moléculas gaseosa es fija para cada una. Pero esto, no quiere decir que todas las partículas tengan la misma velocidad, sino que hay una distribución de las velocidades (unas más rápidas que otras). Para entender esto, basta con imaginarnos que inicialmente todas ellas poseen la misma velocidad pero a medida que el tiempo avanza y los choques ocurren algunas moléculas pueden ir perdiendo velocidad y otras ganándola. No obstante, como el número de moléculas es muy grande siempre habrá un promedio que conserve una velocidad específica. Y esto puede representarse con un gráfico como el de la figura siguiente, que es una campana gaussiana.
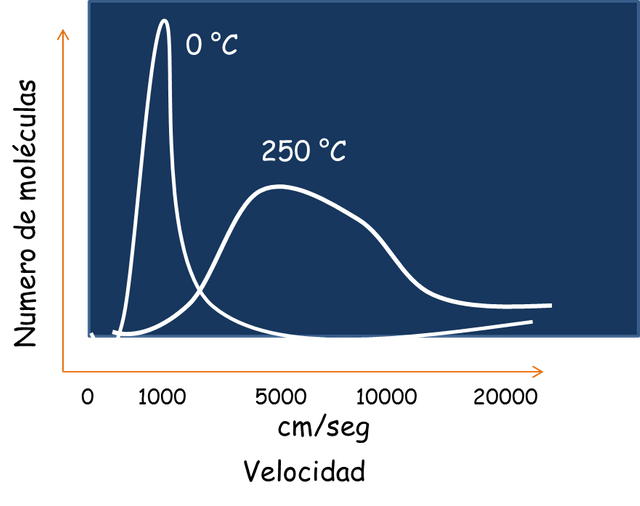
Distribución de velocidades.- Fuente: @VianniS
El área debajo de la curva abarca el número de moléculas a una T específica. Si la temperatura del sistema es aumentada de manera brusca la velocidad de una parte de las partículas también aumentará y la distribución de velocidades cambiara. Esto se ejemplifica en la figura anterior.
Gases Reales
Todos los gases que siguen cada una de las leyes definidas y ejemplificadas anteriormente son conocidos como gases ideales. En una atmósfera en condición normal cada uno de los gases actúa como un gas ideal. Pero ¿Qué sucede si aumentamos las presiones y disminuimos las temperaturas hasta valores críticos?
Como se muestra en la figura siguiente, las partículas se vuelven independientes unas de otras y se alejan de la conducta ideal. Es decir, las fuerzas intermoleculares se pierden.
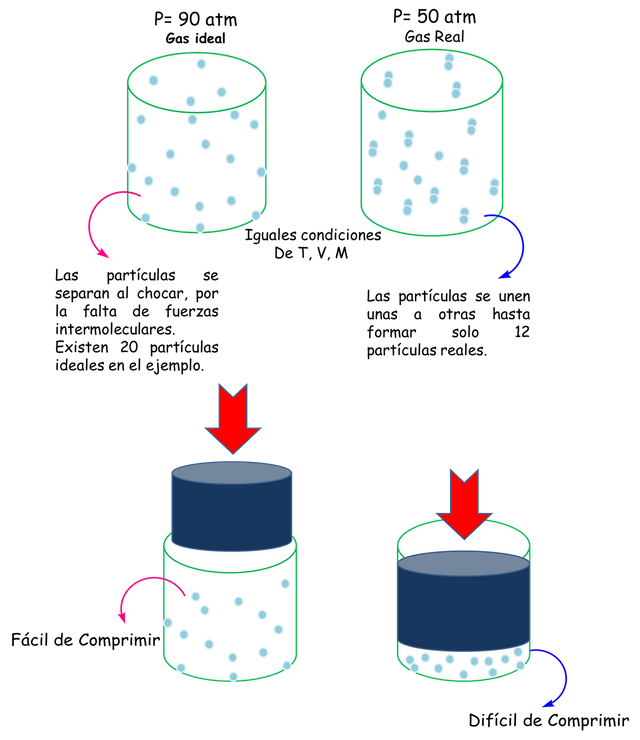
Gases ideales vs reales.- Fuente: @VianniS
Explicándolo de otra manera, las partículas de un gas real dominan espacios y tienen atracción entre sí. Si incrementamos la presión con la disminución del volumen las partículas obviamente se acercaran mucho más una a las otras. Estos acercamientos hacen que se unan entre sí y se queden pegadas disminuyendo así el número de moléculas. Esta disminución hace que la presión de un gas real sea más baja que la de los ideales. Como se ve en la figura.
Si continuamos disminuyendo el volumen por medio de un pistón, las partículas se unirán mucho más, y menos espacio vacío quedara en el recipiente en un momento determinado. Entonces el volumen ocupado por las partículas será más grande comparando con el del recipiente. Si quisiéramos reducir más el volumen sería necesario comprimir más el gas, y como les comenté al principio las partículas de un gas son incomprensibles. Y como conclusión se llega que al aumentar la presión de los gases reales se obtiene un decrecimiento menor de volumen que en los gases ideales. Observe la figura de arriba.
Este tema puede extenderse mucho más debido a que estamos rodeados de gases, pero mis objetivos propuestos al principio del post de hablarle de todas las propiedades y fenómenos que rigen los gases han sido alcanzados hasta este punto. En próximos post podemos seguir nutriéndonos de estos temas químicos.
Nota: Todas las imágenes son de mi autoria exceptuando la primera.
Y por supuesto, si aún no perteneces a la comunidad científica de #Stem-espanol y quisieras optar por la curación de contenido te extiendo la invitación a nuestro canal de Discord para que conozcas los criterios y normas establecidos por los curadores de esta comunidad. Pero te adelanto que si tus intensiones son el plagio, la mala ortografía y contenido nada original no tendrás éxito con nosotros. Porque una de las característica de esta comunidad en crecimiento es curar solo contenido de calidad.
Referencias
Si quieres ampliar más tus conocimientos sobre el tema puedes consultar alguno de los siguientes textos de química avanzada.
- Frank Brescia, Stanley Mehlman, Frank Pellegrini y Seymour Stambler, Quimica, editorial interamericana, página 35.
- Raymond Chang, Química, Editorial, McGraw Hill, página 153.
- Engel Reid, Química Física, editorial Pearson páginas 128.
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por el constante apoyo.
Terrible escrito, Viannis!!!!! un placer leerlo!!!!
En estas transformaciones de los estados de la materia siempre hay un consumo de energía, a pesar que no se cambien las propiedades químicas intrínsecas de la materia. Me gustó el enfoque que le diste al tema de los gases.
Saludos estimada @azulear Gracias por el apoyo.
Fabuloso tema, estimada @VianniS. Los ejemplos que narras son claves para ayudar al lector a entender, sobre todo si no es un lector especialista. Te haré llegar unos aportes. Saludos :D
Gracias por el apoyo mentor. Las correcciones ya las pude realizar agradezco enorme tus aportes.
Hola @viannis trato de corregir un pequeño detalle con el subtítulo ley combinada de gases, también puedes oscurecer y centrar las ecuaciones para mejor visibilidad y aspecto. De resto muy bien!
Gracias @carloserp-2000 por las sugerencias. No había notado lo del subtitulo ya lo corregí.
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @utopian-io and @curie.
If you appreciate the work we are doing then consider voting all three projects for witness by selecting stem.witness, utopian-io and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Thanks team.
Hi @viannis!
Your post was upvoted by utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thanks for the support team @utopian-io
Excelente escrito, además presentado de manera didáctica. Saludos y feliz día.
Saludos estimado amigo. Gracias por tu apoyo.
que bueno amiga, se ve que te esforzaste por presentar semejant post..
Gracias por el apoyo estimado.
Excelente la explicación @viannis, muy didactica, me han encantado las imagenes, te quedaron muy bien! Oye deje algo por el canal de química, pasate a ver cuando puedas. Mis saludos amiga.
Hola Emilio. Gracias por el apoyo. Ya paso por el canal. Mi internet ha estado algo malo por eso no he pasado por allá.