Elementos Y Compuestos De Grupo (VIa). O, S, Se, Te, Po
Saludos estimados lectores miembros de la comunidad de #Steemit y especialmente a los integrantes de #Stem-espanol. La tierra está compuesta por cada uno de los elementos de la tabla periódica, en diferentes proporciones, estados y composiciones. Cada uno de estos elementos con una función específica. En la tabla periódica se encuentran ordenados de acuerdo a sus propiedades, características y similitudes en los diferentes grupos y periodos como se muestra en la figura siguiente. En este post les mostraré algunas propiedades del grupo VIa o 16. O como es conocido el grupo del oxígeno.
Introducción
A este grupo de la tabla periódica pertenecen los elementos Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te) y Polonio (Po), a los que se les conocen como calcógenos, Estos elementos tienen una configuración ns2np4. Y son los elementos más comunes, encontrándose formando sales oxigenadas, óxidos o sulfuros en la superficie del planeta
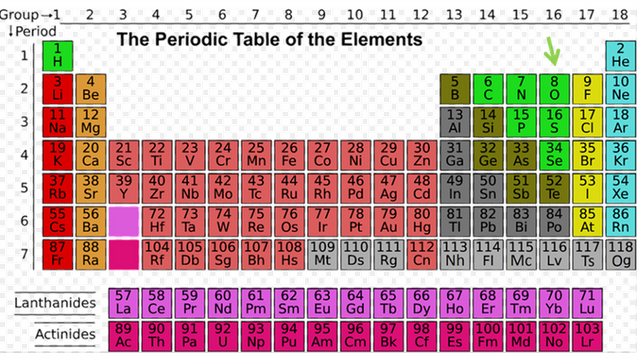 Tabla Periodica
Tabla Periodica El oxígeno representa aproximadamente el 55,5% de la masa de la faz de la tierra. Y en segundo lugar se encuentra el azufre. Los otros integrantes de este grupo son menos frecuentes. El elemento más raro es el polonio, y este se obtiene como intermediario de una desintegración, y con una vida media muy corta. La denominación de calcógenos hace referencia a la formación de minerales. De este grupo solo el oxígeno y el azufre están en la naturaleza en sus estados elementales, y en algunos casos formando sulfuros, sulfatos y óxidos.
Las características y propiedades del O lo hacen diferente a los otros elementos de este grupo, Además de ser el único elemento en estado gaseoso diatómico a temperatura ambiente (hasta 40 grados centígrados), también es un elemento claramente no metálico igual que el azufre, por otro lado, El azufre, selenio, telurio y polonio son sólidos y presentan estados alotrópicos, es decir, esto significa que elementos simples poseen diferentes arreglos estructurales,
Las apariencias físicas también son muy distintas por ejemplo el azufre es un sólido de color amarillo claro y está formado por una serie de moléculas cíclicas conformadas por ocho átomos. El polonio un metal pesado muy radioactivo que es imposible de estudiar en un laboratorio común de investigación. El Selenio tiene 3 formas alotrópicas, rojo, negro y gris y por último el Telurio es de color gris y tiene el carácter más metálico de todos.
Estos metales no presentan reacción en presencia del agua a excepción del azufre que es sensible. De forma análoga comparten la característica de que no reaccionan con las bases, pero si con los ácidos.
Pueden notar que los elementos debajo del oxígeno forman dióxidos con él. Reaccionan con metales y forma los respectivos óxidos y calcogenuros metálicos, con estabilidades diferentes. Estos elementos al reaccionar con otros elementos o compuestos tiene varias posibles formas de acción entre las que se destacan: la pérdida de electrones y comportamiento como cationes en las sales o viceversa con ganancia de electrones y comportamiento como aniones en las sales, pueden formar enlaces covalentes: al compartir los electrones desapareados de la capa de valencia (Genera 2 enlaces sencillos o formación de un enlace doble), uso de los pares de electrones libre (Disminuyendo la fuerza de los enlaces con otros átomos que presenten también pares electrónicos o fortificando el enlace con átomos que tengan de orbitales disponibles), o usando los orbitales de energía adecuada en la formación del enlace.
Estos elementos crean hidruros de fórmula de la forma general XH2 que a excepción del agua que es líquida, inodora, necesaria en nuestra alimentación, neutra y estable e imprescindible, estos son gases venenosos, de olor fuerte y desagrádales, de carácter ácido e inestable.Tomando en cuenta lo anteriormente expuesto tuvo por objeto el estudio de las propiedades del grupo VIA.
Metodología Experimental Desarrollada y Resultados obtenidos.
Alotropías del azufre.
Se colocó en un tubo de ensayo seco, una cantidad apreciada de azufre en polvo, luego se calentó con un mechero y agitando poco a poco y se prosiguió hasta su ebullición. Posteriormente se agregó agua destilada fría, se dejó en reposo aproximadamente 5 minutos.

Alotropía del Azufre a b. Fuente: @VianniS
Cuando se calentó el azufre, este se fundió dando origen a un líquido de color amarillo como se muestra en la figura b. Seguidamente, comenzó a oscurecerse cambiando su tonalidad a un color marrón el cual fluía con mucha dificultad. Al transcurrir un periodo de tiempo, este líquido recuperó fluidez, y se coloreó rojo oscuro. Finalmente, al agregarlo al recipiente con agua, se tornó como una pasta amarilla maleable.

Azufre-Fuente: @VianniS
De acuerdo a varios autores, la forma termodinámicamente más estabilizado del azufre, es el azufre ortorrómbico con anillos con 8 miembros, estos al calentarse forman un líquido móvil claro, y al aumentar la temperatura, cambia a café y aumenta su viscosidad alcanzando un hasta 200 ºC luego vuelve a ser un líquido muy móvil de color rojo oscuro.
La viscosidad cambia por el quebrantamiento de los anillos y la formación de cadenas, así como otras especies en equilibrio con anillos de azufre de hasta 20 miembros. El color rojo se debe a la formación de especies de 3 y 4 azufres que absorben la luz visible a mayores intensidades y hace que ocurran los desplazamientos en las respectivas bandas asociadas al color.
Finalmente, al añadir el azufre fundido en agua helada, se obtuvo el llamado azufre plástico (véase Figura siguiente), fibras de azufre ortorrómbico que pueden ser estiradas debajo del agua.
 Azufre Plástico -Fuente: @VianniS
Azufre Plástico -Fuente: @VianniSAzufre monoclínico.
En un tubo de ensayo se colocaron 10 mL de Xileno con unos gramos de azufre en polvo, luego se sello el tubo usando un tapón de goma mono horadado el cual contenía un tubo de desprendimiento, se calentó el tubo que contenía la solución de Xileno con el azufre y se dejó enfriar.
Al agregar el azufre al solvente orgánico no se observó algún cambio físico apreciable y al calentarlo se solubilizó totalmente en el solvente. No obstante, al enfriarlo se pudo observar la formación de pequeñas partículas difíciles de detallar a simple vista en la solución.
En la literatura se expone que el azufre monociclo, se consigue al enfriar gradualmente el azufre rómbico fundido. Cuando se expone a altas temperaturas el azufre rómbico en un solvente orgánico y posterior enfriamiento, sus características fisicoquímicas hacen posible la observación de un acumulado de largas agujas transparentes antes de la solidificación completa. Esto se debe a su electronegatividad y carácter no metálico. Esto se explica porque los cristales del azufre monoclínico trasparentes se vuelven opacos al pasar a la variedad rómbica, convirtiéndose en agujas de cristales microscópicos de azufre rómbico.

Grupo VIa-Fuente: @VianniS
Reacción del S en polvo con HNO3.
En un tubo de ensayo se colocó una mínima cantidad de azufre en polvo y se añadió ácido nítrico concentrado. Luego, la mezcla fue calentada hasta ebullición, se dejó enfriar y agregaron unas gotas de solución de cloruro de bario (BaCl2).
Al mezclar ácido nítrico concentrado y azufre en polvo, no se exhibió algún cambio físico notable a primera instancia. Sin embargo, cuando se calentó se apreció el desprendimiento de gases de color marrón desde el tubo de ensayo, y la solución se coloreó amarilla. Cuando se agregaron las primeras gotas de la solución de cloruro de bario, de manera instantánea, se observó la formación de un precipitado de color blanco en el fondo del tubo de ensayo.
Los ácidos oxidantes, como el ácido nítrico (HNO3), atacan al azufre caliente. Y lo hace oxidar de su estado elemental hasta +4, mientras que el nitrógeno se reduce de su estado de oxidación +5 a +2, produciendo ácido sulfúrico y óxido nitroso según la reacción:
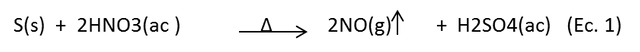
Donde el ácido sulfúrico producido en la primera reacción, quedó en el matraz y reaccionó con el cloruro de bario añadido después. El fenómeno descrito sigue la siguiente reacción:
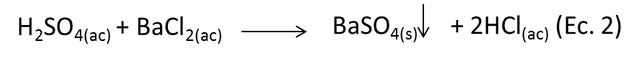
Si el azufre está en solución como radical sulfato, se puede determinar por precipitación utilizando cloruro de bario, para dar sulfato de bario, que se describe como un sólido cristalino blanco.
Reacción entre el Na2 SO3 y HCl.
Se trató una solución de sulfito de sodio con ácido clorhídrico diluido.
Cuando se añadió el ácido clorhídrico al sulfito de sodio, se logró observar una reacción rápida, que solubilizó por completo el sulfito de sodio. Cabe destacar, que esta reacción estuvo acompañada de una intensa efervescencia, que luego se convirtió en un constante burbujeo de un vapor incoloro.
El ácido clorhídrico diluido reacciona con una sal del ion sulfito, provocando su descomposición, la cual es más rápida al calentar, con el desprendimiento de dióxido de azufre según la reacción:
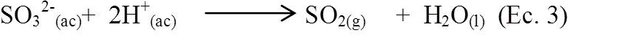
Reacción entre AgNO3 y Na2 SO3.
En un tubo de ensayo se trató una solución de nitrato de plata 0,1 N con una solución de sulfito de sodio, añadiendo este último gota a gota.
Cuando se añadió a una solución de nitrato de plata 0,1 N una solución de sulfito de sodio gota a gota, al cabo de unos minutos se pudo observar la formación de un precipitado de color blanco en el fondo del tubo de ensayo.
Cuando se mezclan el sulfito de sodio y de nitrato de plata en solución acuosa, se genera un precipitado, una turbidez o un sólido, de sulfito de plata y queda en solución acuosa el nitrato de sodio. La formación del sólido durante la reacción se da poco a poco sólido poco a poco, según la siguiente reacción:
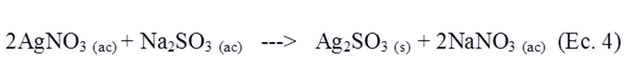
A nivel molecular lo que ocurre, es que los iones plata (Ag+) y los iones sulfito (SO3 -2) se unen para generar atracciones muy fuertes, mucho mayor que las fuerzas de disociación que el agua ejerce sobre ellas, además, el átomo de plata es muy grande y hace que el sulfito precipite.
Disposiciones Finales
• Se observo la formación del azufre “plástico”, por calentamiento y enfriamiento sucesivo, en este proceso se observo un variado cambio de color hasta obtener un liquido color amarillo brillante.
• Se logró la formación del azufre monoclínico (partículas finas transparente las cuales fueron difícil de observar en primera instancia) a partir de azufre ortorrómbico usando un solvente orgánico (Xileno).
• Se observó la formación de un precipitado de sulfato de bario, BaSO4, de color blanco en toda la solución.
• Se logró la descomposición del ión sulfito a dióxido de azufre al hacer reaccionar acido clorhídrico con sulfito de sodio.
• Se exhibió la formación de un precipitado de sulfito de plata, Ag2 SO3, al hacer reaccionar sulfito de sodio con nitrato de plata.
Si te gusto este post y quieres seguir leyendo articulo de calidad te invito a nuestra etiqueta científica de habla hispana #Stem-espanol y si quieres pertenecer a nuestra comunidad puedes entrar al canal de Discord e interactuar con personas con muuuucho conocimiento científico por compartir.
Consultas Bibliográficas.
- Cotton, F. Albert. 1972 Quimica Inorganica Avanzada. 3era Edicion. Interscience publishers. Estados Unidos.
- Babor; Ibarz, 1958, Química General Moderna, 6ta edición, México.
- Semishin V, 1967, Prácticas de química general inorgánica, Moscú.
- Brown G., Salle E., 1977, Química cuantitativa, Ed. Reverté, Barcelona. España.
- Svehla, G., 1979, Vogel’s Textbook of Macro and Semimicro Qualitative Inorganic Analysis, Ed. Longman, 5ta edición.
- Dickerson R., 1992, Principios de Química, Ed. Reverté.
Estas participando para optar a la mención especial, que se efectuará el 29 de Julio del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por el apoyo. Sigan creciendo como comunidad
Saludos @viannis, me ha gustado tu demostración de la alotropía del azufre, la tendré en cuenta cuando hable sobre el diagrama de fases de este compuesto en mis clases.
Gracias estimado profesor. Realmente son ejemplos muy sencillos de hacer y con mucho valor cientifico.
Saludos mi estimada @viannis, me gusto tu artículo, muy didactico, empezando a mostrar algunos elemento contenidos en la tabla períodica, de los elementos mostrados me llamo mucho la atención el asufre, ya que ubicándome en el área agropecuaria es un elemento utilizado para el control fúngico (hongos) , en el área agropecuaria e diversos cultivos, el producto elaborado artesanalmente se le conoce como caldo sulfocalcico, y toma ese color amarillo rojizo que muestras en la imagen del azufre fundido. Gracias por compartir, nos seguimos leyendo !
Estimado @amestyj gracias por tu apoyo. El azufre tiene muchas propiedades y entre las que se destacan su toxicidad para los microorganismos por su fuerte olor característico. Saludos
Hola @viannis. Es magistral tu explicación y presentación. Mis felicitaciones por tan excelente trabajo. Gracias por nutrirnos con tus aportes.
Gracias profesor. Me alegra que siempre este pendiente de mis post. Saludos
Con esta publicación, he recordado mis antiguas clases de Química en mis años de estudio en mi Liceo "Instituto Latino" en Maracaibo Venezuela. Felicitaciones @viannis por tus publicaciones y por seguir educando en la materia. Abrazos
Saludos estimada @aisquels gracias por leer mis post y sentirte instruida. :D
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Thanks for the support. Your job is the best.
Hi @viannis!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV