Determinación Total De Acidez En Vinagre y Leche
Introducción
Un importante parámetro que determinar en los alimentos y bebidas de consumo humano para evaluar su calidad, es la acidez. El pH es una medida de la concentración de los iones de hidrógenos presentes en las sustancias. Controlar el pH de estos productos es esencial para conservar las características, como sabor, olor, fermentación y conservación. Métodos comunes para determinar la acidez de los alimentos son las reacciones ácido-base; En esta investigación quisimos estudiar las reacciones de ácidos orgánicos débiles con una base fuerte (NaOH)

Alimentos
Por ejemplo la leche de vaca debe presentar un pH comprendido entre 6,6 y 6,8 siendo la acidez total aquella correspondiente al ácido láctico en mayor proporción. El pH de la leche de vaca o en polvo determina su sabor y calidad. El vinagre, es otro producto comercial de uso común, dependiente del pH, por su concentración de ácido acético y otros ácidos fijos y volátiles, que determinan su calidad.
Debido a la importancia del pH en la calidad de los productos comerciales de consumo humano, se tienen como objetivos principales en esta investigación la determinación de acidez en la leche, vinagre y vinotinto.
Metodología Experimental
Como parte inicial se procedió con la preparación de 500 mL de solución de hidróxido de sodio (NaOH) a una concentración de 0,10 M a partir de hidróxido de sodio sólido el cual se encontraba al 99% de pureza.
Para conocer la concentración molar real de la solución de NaOH recién preparada se realizó una estandarización secundaria con una solución de ácido clorhídrico (HCl) 0,12 M. (Véase tabla #1).
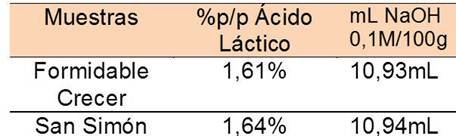
Posterior a ello, se determinó la acidez total a una muestra de leche en polvo. Las muestras de la misma elegidas fueron “Formidable Crecer” la cual es baja en grasas y “San Simón”. Se titularon 3 alícuotas por cada una, que contenían 1 g de leche en polvo en 10 mL de agua destilada, con fenolftaleína como indicador hasta cambio de color incoloro a un rosa pálido. Los volúmenes obtenidos se encuentran vaciados en la tabla 3 y 4.
Seguidamente se determinó la acidez de una muestra de vinagre comercial. Las muestras escogidas fueron EUREKA y MAVESA. Se tomaron 20 mL de cada una, se les aplicaron dos diluciones consecutivas. A partir de la primera dilución con agua destilada se obtuvo una solución de 100 mL al 20% de vinagre. De esta mezcla líquida homogénea se tomó una alícuota de 10 mL donde el 2% (2 mL) era vinagre, solución que fue diluida nuevamente agregando 100 mL de agua, para ser valorada.
Finalmente la solución tratada volumétricamente estaba compuesta por 2 mL de vinagre puro y 108 mL de agua. Por último se tomaron 3 alícuotas de esta última dilución y se titularon con la solución de NaOH y fenolftaleína como indicador hasta el cambio de color de incoloro a rosa. Los volúmenes gastados de hidróxido de sodio se encuentran vaciados en la tabla 5 y 6.
Resultados Obtenidos.
Estandarización
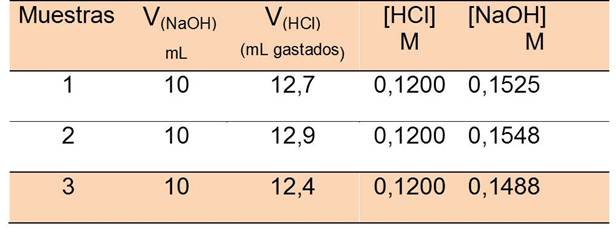
Utilizando una solución de ácido clorhídrico a 0,12 M se estandarizó una solución de hidróxido de sodio preparada siguiendo los pasos mencionados en el procedimiento. Haciendo uso de relaciones estequiometrias se calculó la concentración de la solución. Con las 3 concentraciones, se calcula la media, desviación estándar y coeficiente de variación de la concentración de hidróxido de sodio:
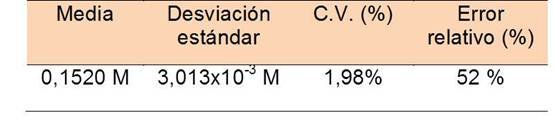
Para conocer la precisión de la estandarización se calculó su coeficiente de variación, este es menor a 5% por lo que las titulaciones tuvieron una buena precisión y carecen en gran medida de errores sistemáticos. Una vez establecida la concentración real del hidróxido de sodio, se utiliza el mismo como solución patrón para titular las muestras problema.
Acidez en leche
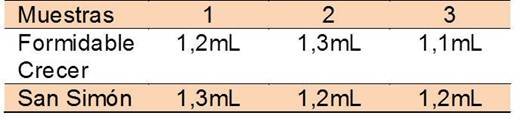
Tras tratamiento estadístico para conocer la precisión del análisis obtenemos que:
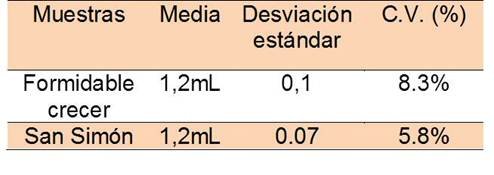
Según los datos vaciados en la tabla 4, para ambos métodos el coeficiente de varianza arrojan más de un 5% de dispersión para el conjunto de datos experimentales obtenidos para el volumen de NaOH consumidos en la titulación de la leche, lo que señala la presencia de errores aleatorios al momento de realizar la experiencia.
La titulación de una muestra de leche con hidróxido de sodio cumple con la siguiente reacción química:
C2H5OCOOH(ac) + NaOH(ac) ↔ C2H5 OCOONa(ac) + H2O
El ácido láctico C2H5OCOOH es un ácido monocarboxílico, es decir, que tiene un solo hidrógeno ácido, por lo tanto la relación entre este ácido y el hidróxido de sodio es 1:1. En la tabla 5 se encuentra el %m/m para cada una de las muestras. Estos cálculos fueron llevados a cabo haciendo uso de relaciones estequiométricas a partir de la reacción mencionada anteriormente. Según la normativa vigente la acidez suele expresarse como los gramos de ácido láctico contenidos en 100 g de leche.
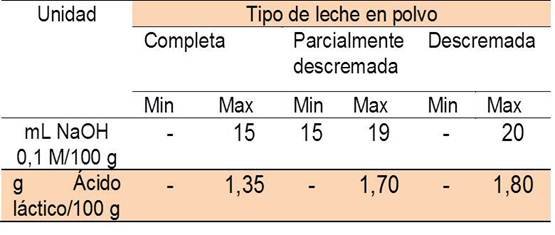
Como guía a este procedimiento hacemos uso del siguiente cuadro.
Extraído
Comparando los resultados obtenidos en la experiencia con los establecidos en la norma Covenin, la acidez de las muestras de leche está entre los límites permisibles y pueden considerarse ambas muestras tratadas entre Leche en polvo completa y parcialmente descremada. Sin embargo, la acidez de la leche debe oscilar entre 15 y 21 mL de NaOH 0,1M/100 mL de leche y los datos experimentales arrojaron valores por debajo del valor máximo permitido o tomado como parámetro para calificar la calidad del producto de consumo humano estudiado en esta parte del procedimiento. Tomando tales cifras es necesario el cálculo de exactitud del método a través del error relativo. El error relativo porcentual queda definido como el cociente entre el error absoluto y el valor teórico o aceptado multiplicado por 100. Se obtuvo un valor del 31,6% para ambas muestras, lo que permite clasificar el método de valoración de la leche como extremadamente inexacto, evidenciándose la presencia absoluta de errores sistemáticos en el procedimiento. Es posible atribuir las fallas experimentales a las dificultades para observar el punto final de la titulación, ya que ésta se llevó a cabo sin el uso de la solución patrón de coloración por ausencia del reactivo (acetato de rosanilina).
Adicionalmente a esto es posible que se desencadenara la interferencia de otros ácidos presentes en la muestra de leche valorada, tales como ácido pantoténico, fólico, linoleico, que si bien no superan la cantidad de ácido láctico en la muestra, es probable que parte del hidróxido de sodio consumido reaccionara con éstos, lo que implicaría un error en la valoración. Debido a que el procedimiento arrojo datos experimentales incongruentes, no es posible apreciar la calidad de las muestras de leche estudiadas.
Por último se realizó el análisis correspondiente a las muestras de vinagre comercial.
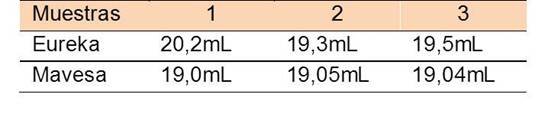
Los volúmenes gastados de hidróxido de sodio, muestran cierta dispersión, por lo que es necesario el cálculo de la precisión, a través de la desviación estándar y el coeficiente de varianza.
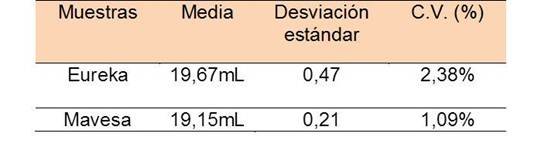
Los resultados obtenidos demuestran que el procedimiento presenta en gran medida bajos indicios de error aleatorio o indeterminado que afectan la precisión, lo que indica que relativamente se hizo un buen tratamiento de la muestra, en cuanto a la toma de medidas, y diluciones, es posible que la varianza en los datos esté influenciada por la dificultad en la apreciación del punto final en el cambio cromático de la fenolftaleína.
En la valoración del vinagre con el hidróxido de sodio, se da principalmente la siguiente reacción química:
CH3COOH (ac) + NaOH (ac) ↔ CH3COONa (ac) + H2O
Es evidente que la reacción entre el ácido acético y el hidróxido de sodio ocurre en una relación 1 a 1, por lo tanto es correcto expresar que el # de moles de NaOH = # moles de CH3COOH. En la tabla 8 se encuentra el %m/v para cada una de las muestras. Estos cálculos fueron llevados a cabo haciendo uso de relaciones estequiométricas al igual que para las muestras de leche. Según la norma Covenin 47-90 Vinagre 2da Revisión, la acidez suele expresarse como los gramos de ácido acéticos contenidos en 100 mL de vinagre.
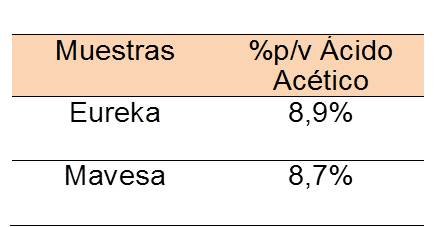
La norma mencionada anteriormente establece que los vinagres comerciales han de tener un contenido mínimo de ácidos equivalente a un 5% (p/v) de ácido acético. Claramente se observa en la tabla anterior que los datos experimentales obtenidos difieren del valor máximo permitido. Tomando tales cifras, es de gran utilidad el cálculo de exactitud del método a través del error relativo. En el mismo se obtuvo un valor igual al 74,0%.
Disposiciones finales
Se determinó la acidez, en soluciones de sustancias de uso común, tales como leche en polvo, vinagre, y vino mediante la valoración con solución patrón de hidróxido de sodio estándar 0,1520 M, una concentración bastante alta en relación con la esperada (=̃ 0.1 M), utilizando indicadores visuales como fenolftaleína para leche y vinagre. El tratamiento del vinagre arrojó una acidez de 8,90 grs en 100 mL de solución, siendo un valor muy alto en comparación con el valor teórico. El método para el análisis de la leche se conceptuó como inexacto luego de los tratamientos estadísticos, sin embargo se logró un indicio de acidez de 1,61 grs de ácido láctico en 100 grs de muestra.
Si te gusto este post y quieres seguir leyendo articulo de calidad te invito a nuestra etiqueta científica de habla hispana #Stem-espanol y si quieres pertenecer a nuestra comunidad puedes entrar al canal de Discord e interactuar con personas con muuuucho conocimiento científico por compartir.
Bibliografía.
- Skoog, D; West, D. (1988) “Química Analítica”. Cuarta edición. McGraw-Hill. Capítulo 6: introducción a los métodos volumétricos. Pág. 134.
- Skoog, D; West, D. (1988) “Química Analítica”. Cuarta edición. McGraw-Hill. Capítulo 8: Teorías de las valoraciones de neutralización. Pág. 174.
- Skoog, D; West, D. (1980) “introducción a la química analítica”. Editorial Reverté, s.a. Capítulo 15: aplicaciones de las volumetrías de neutralización. Pág. 339
- Horta Zubiaga. Técnicas Experimentales de química. Editorial UNED. España.
- Skoog, D., West, D., Holler, F., Crouch, S. (2005). Capítulo 6: error aleatorios en el análisis químico en “Química Analítica”. Octava edición. Editorial Thomson. Páginas 107-114.
- http://www.sencamer.gob.ve/sencamer/normas/658-97.pdf.
- Riaño, N. (2007). Capítulo 7: volumetría, en “Fundamentos de química analítica básica”. Segunda edición. Editorial Universidad de Caldas. Manizales, Colombia. Págs. 194-198
- http://www.sencamer.gob.ve/sencamer/normas/1481-01.pdf.
- http://www.sencamer.gob.ve/sencamer/normas/47-90.pdf


Estas participando para optar a la mención especial, que se efectuará el 15 de Julio del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Muy bueno tu trabajo, explicado en forma sencilla y cordial. Pocas persona saben la labor del personal de control de calidad de los alimentos. de ellos depende que todo este higiénico y NO TOXICO.
GRacias estimado por tu comentario. Y cierto mucho no saben el trabajo previo al consumo de algún alimento procesado.
La importancia que reviste esta investigación no sólo en la preservación de los alimentos en cuestión, sino en el grado del daño que pueda ocasionar a nivel gástrico los niveles de pH. Te felicito por este post.
Gracias estimado. Tienes razón en tu opinión. saludos
Excelente trabajo, las apreciaciones del pH son de suma importancia de igual manera para el campo de la biologia. Feliz día.
Gracias amigo por estar siempre pendiente de mis posts. Exitos para ti.
Buen post @viannis, estos análisis son fundamentales para el control de calidad de los alimentos, más en lo que se refiere a la acidez. Comparto el análisis que las desviaciones pudieran ser causadas por interferencias de otros ácidos. Oye mencionaste también la acidez en vino, ¿cómo te fue en la valoración de este?
Hola querido Emilio. Esto resulto un tantito difícil por el color del vino, debido a que el viraje del color era a rosa tenue y la dilución del vino no elimino del todo el color rojo de este. Por eso no muestro los resultados. estamos evaluando otro indicador u otro método para este proceso.
Saludos @viannis. Ok, me imagine alguna situación así debido al color. Vale, esperamos saber de los resultados con otro método a ver que tal
Saludos @viannis. Sin duda que tus aportes son de primera. Gracias por compartir.
Gracias profesor, por siempre leerme y comentarme. Sus post tambien son de primera.
La química de los alimentos es un mundo increíble, y más para nosotros donde los sellos de seguridad (nuestra antigua MARCA NORVEN) brillan por su ausencia. Es una forma de corroborar que los productos cumplen con sus estándares. Gracias por tu post, interesante.
Gracias querida @ennyta por el apoyo brindado.
Excelente aporte @viannis, nos muestras como el ph es un factor determinante en la calidad de los alimentos.! saludos
Gracias por leer estimado @amestyj
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Thanks for the support.
Buenos dias. Mis respecto a tan importante labor que usted realiza. Me causa tranquilidad saber que existen cientificas como usted que se preocupan por mejorar la calidad de vida de todo los seres humanos al realizar investigaciones como la que recien lei. Felicitaciones y seguiremos en contacto. Saludos