Determinación colorimétrica de hierro con tiocianato espectrometría UV-Visible
Saludos estimados amigos de esta red social #Steemit. Especialmente a la comunidad de #Stem-espanol. El análisis de calidad de los alimentos procesados es de suma importancia para la correcta distribución de ellos. Y la química es una de las herramientas mas importantes para estos análisis de calidad. Para mostrarles esto, en la siguiente publicación les explico unos ensayos de laboratorios para determina la cantidad de hierro que puede tener presente un producto comercial muy utilizado en Venezuela, la Harina PAN.
Introducción
El hierro es el metal de mayor proporción solo después del aluminio y también entre los elementos de la tabla periódica de mayor abundancia esta entre los primeros 10. El hierro (como se simboliza en la tabla periódica Fe, por su traducción del latín Ferrum) se encuentra en la tierra formando minerales como Fe3O3, FeO(OH) y FeCO3. Que son solubles en ácidos diluidos, no oxidantes. Y si se carece de la presencia del aire se obtiene el Fe II. Mientras que si hay aire presente el metal se oxida a Fe III.

Hierro mineral
Existen diversos métodos de laboratorio empleados para determinar la presencia de hierro en muestras problemas, el organismo, muestras desconocidas entre otras. Uno de ellos es el método colorimétrico que se baja en la formación de un complejo de hierro coloreado con tiocianato. Esto se puede hacer mediante determinación espectroscópicas por radiación UV-Visible. Esta técnica de absorción es ampliamente utilizada debido a que puede identificar cientos de especies orgánicas e inorgánicas entre las que se destacan los grupos cromóforos coloreados como los complejos de hierro en muestras de suelo o en productos alimenticios enriquecidos con este mineral.
El Hierro es un metal que tiene varias funciones en los organismos vivos, por ejemplo en el cuerpo humano es el responsable de la formación de proteínas que se encargan del transporte del oxígeno en la sangre (hemoglobina), también tiene la tarea de aumentar la fuerza del sistema inmunológico para evitar contagiar algunas enfermedades infecciosas. Cuando en las personas existe la deficiencia de hierro es posible que aparezca la anemia, que tiene sistemas característicos como apatía, palidez, fatiga y cansancio constante. En contra parte cuando existe el exceso de este metal en el cuerpo la producción de radicales libres del oxígeno se forman y como consecuencia pueden ocurrir alteraciones hepáticas y mal funcionamiento del páncreas.
El objetivo de esta publicación es evaluar una muestras de Harina Pan comercial y cuantificar el hierro presente mediante el método de curva de calibrado, utilizando la técnica de espectrometría de absorción UV-Visible. Para esto se formara un complejo coloreado por transferencia de cargas de hierro.

Harina referencial
Se denominan complejos de transferencia de cargas a aquellos donadores electrónicos que se encuentran unidos a un aceptor electrónico. Entonces como en todas las técnicas espectroscópicas donde la radiación excita a los electrones de las últimas capas de valencia, uno de estos electrones se transfiere del orbital del donador al del aceptor. En el caso de esta práctica el método colorimétrico empleado para la determinación de Hierro se basa en la formación de un complejo coloreado de Hierro (III) con el tiocianato, donde es indispensable que el Hierro tenga un estado de oxidación +3, es decir Fe (III) . Cuando el complejo ya toma el color rojo, la coloración es estable por un largo tiempo, de allí su adjetivo colorimétrico. Como han leído en varios post anteriores de mi autoría, la espectroscopia de absorción basada en la radiación, son técnicas muy utilices para realizar análisis cuantitativos.
Parte experimental
En primer lugar se procedió a preparar una solución estándar a partir del sulfato amoniacal de Hierro, FeNH4(SO4)2 (Fisher 99,0% de pureza), para ello se pesaron 0,8607 g, se enrazó hasta 100 mL para una concentración de 1000 ppm de Fe, de esta solución se tomó una alícuota de 10 mL y se diluyo en 100 mL con agua destilada, para obtener una concentración menor de 100 ppm de Fe esto fue la solución patrón.
Luego en un balón de 50 mL se agregó 1 mL de la solución patrón, 1 mL de peróxido de hidrógeno, H2O2, 5 mL de ácido nítrico, HNO3, 10 mL de tiocianato de potasio, KSCN (Scharlau 99% de pureza) y se enrazó con agua destilada. se repitió el procedimiento anterior, variando el volumen de la solución patrón 2 mL, 3 mL, 4 mL, y finalmente 5 mL.
El blanco correspondiente fue preparado con 1 mL de peróxido de hidrógeno (H2O2), 5 mL de ácido nítrico (HNO3) y 10 mL KSNC. Luego de preparar todas las soluciones, se midieron las absorbancias de cada una de ellas.
Por otro lado, para la determinación de hierro en la muestra de harina Pan, se pesaron dos veces, 0,25 g de harina de maíz en vasos de precipitados, para cada una se le agregó 1 mL de peróxido de hidrógeno, 5 mL de ácido nítrico, 15 de agua, 2 mL de HCl. Las dos muestras, conjuntamente con el blanco se colocaron en una plancha de calentamiento a 100°C aproximadamente durante 45 min, esto con la finalidad de inducir el proceso de digestión, luego de culminado dicho proceso (cuando se disolvió todo el sólido) se dejó enfriar las tres soluciones para luego filtrar. Cada una de ellas se diluyó en balones de 100 mL, de ellas se tomaron alícuotas más pequeñas para una segundo dilución esto con el fin de llevar la solución a una concentración de 100 ppm de Fe aproximadamente, posteriormente, se tomaron 4 mL de cada una de estas soluciones y se trasfirieron a balones de 50 mL, junto con 1 mL de peróxido de hidrógeno, H2O2, 2 mL de ácido nítrico, HNO3, 10 mL KSCN y se aforó con agua destilada y finalmente se midieron las absorbancias de las tres soluciones, utilizando dos espectrómetros UV/Vis, el Perkin Elmer UV/Vis y el Spectrometer Lambda11.
Análisis de los resultados obtenidos
En primer lugar se corrigieron las señales obtenidas retándoles la señal del blanco, para así proceder a la construcción de la curva de calibración, en las tablas siguientes (tabla 1 y 2) se muestran dichos valores correspondientes a los dos equipos utilizados para la determinación de las absorbancias (lambda11 y Genesys 20).
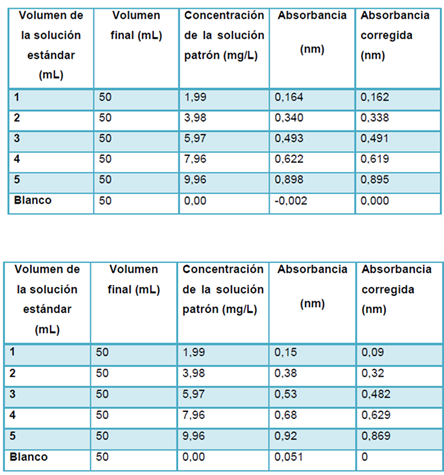
Para la preparación de la solución estándar se utilizó un patrón de alta pureza FeNH4(SO4)2 (alumbre férrico; 99,0 %), para así minimizar interferencias al medir las absorbancias, por otro lado se agregó el peróxido de hidrógeno, H2O2, como agente oxidante para así garantizar el cambio de estado de oxidación de Fe (II) a Fe (III) y ácido nítrico, HNO3, esto para propiciar el carácter acido en la solución y evitar en cuestión la hidrólisis de metal, por otro lado se añadió el tiocianato, KSCN, induciendo la formación del complejo coloreado (rojo).
A continuación se muestran las gráficas (curvas 1 y 2) representativas de las curvas de calibrado para la determinación de Hiero en las muestras de Harina Pan, por los dos espectrofotómetros UV-Visible construida en base a los valores de concentración (eje X) y las absorbancias (eje Y).
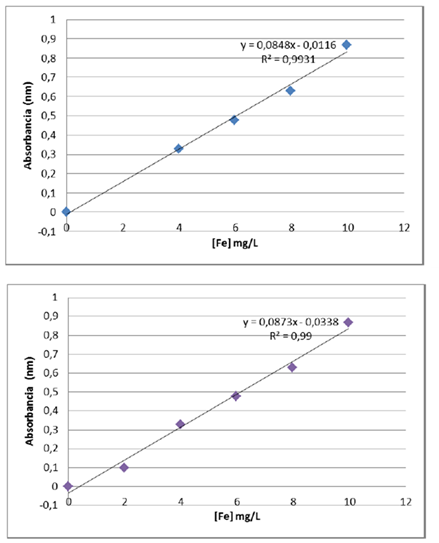
Curvas 1 y 2 Curva de calibrado equipo Lambda 11 y Genesys 20-Fuente: @VianniS
Estas curvas muestran una gran linealidad en ambos equipos, la sensibilidad de calibración es representada a través del valor de la pendiente de la curva de calibrado, Si la curva de calibrado es lineal, la sensibilidad es constante e independiente de la concentración, es decir, debido a esto y luego de observadas las Figuras 1 y 2 se revela que ambos equipos proporcionan curvas de calibrado de alta sensibilidad.
Otra forma de expresar la sensibilidad del método, es mediante el límite de detección el cual se define como la mínima señal que puede medirse en un experimento pero no cuantificarse con un valor exacto. Es decir que el límite de detección, en nuestros análisis, es aquella concentración que proporciona una señal en el instrumento particularmente distinta de la señal de una muestra en blanco:
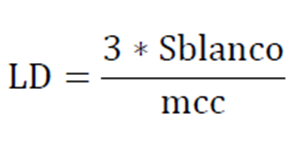 Ec 1
Ec 1 Por otro lado el límite de cuantificación se define como la magnitud mínima que puede determinarse con un nivel aceptable de exactitud:
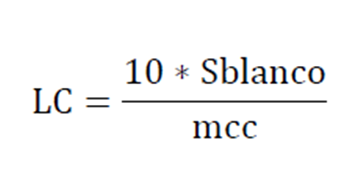 Ec 2
Ec 2 La tabla siguiente se revela los límites de detección y límites de cuantificación en cada uno de los equipos.
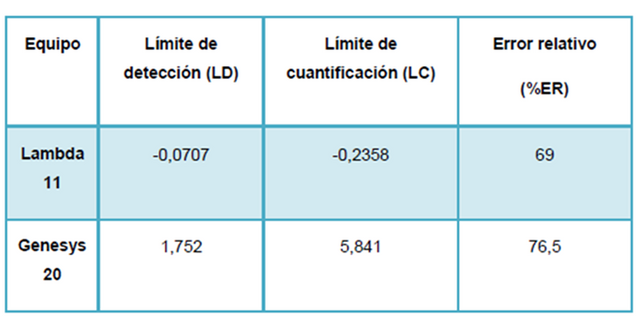
Esto revela que el Lambda 11 es más sensible que el Genesys 20, por otro lado el Genesys 20 es más exacto al tomar de referencia el valor de LC y LD obtenido. A continuación se muestran los resultados de las muestras de harina Pan tratadas en esta práctica:
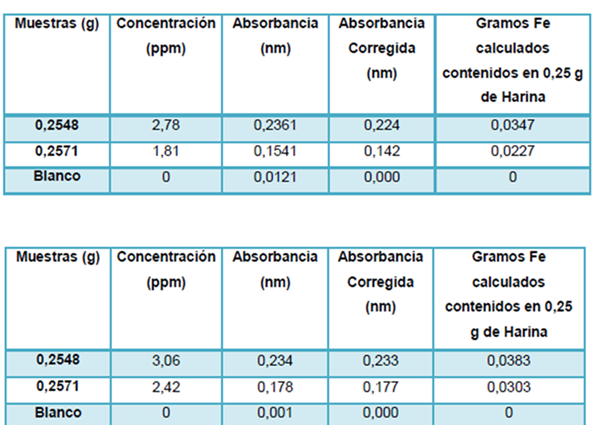
Para la determinación de las concentraciones de hierro en las muestras de harina se tienen las absorbancias que se arrojan en las tablas anteriores. Las muestras fueron tratadas de la misma manera, con la concentración requerida para contener una cantidad específica de Fe que arrojaría una absorbancia dentro del rango de la curva de calibración previamente construida.
El HNO3 es un fuerte oxidante que se introdujo con la finalidad de destruir toda la materia orgánica que se encuentra en el analíto (Fe), además de estar atrapada dicha estructura en una red. El ácido nítrico tiene como propósito llevar todos los elementos involucrados en dicha materia de su forma covalente a su forma más pequeña, generando óxidos de cada uno de los elementos, óxido de nitrógeno y agua, lo cual puede eliminarse fácilmente por evaporación quedando en solución solo el analíto mas los fosfatos y sulfatos insolubles. El HCl presente se utilizó para mantener el pH de la solución y el agua con el fin de que la reacción no fuera violenta y pudiera salpicar en el transcurso del calentamiento.
Es importante que esta solución se mantenga a pH ácido, para evitar que el metal se hidrolice, cuya hidrólisis formaría complejos con grupos hidroxilos de color amarillo y generaría interferencia en las medidas. El peróxido de hidrógeno, H2O2, se utilizó tanto en el tratamiento de la muestra como en la preparación de las soluciones para la construcción de la curva de calibración, este compuesto tiene como objetivo oxidar el Fe de su estado +2 a Fe +3, otra de las razones de utilizar el peróxido es que dicho compuesto es incoloro y por tanto no existiría ningún tipo de interferencia a la hora de la medición de la absorbancia. No son utilizados otros oxidantes como el permanganato de potasio y dicromato, debido a que son coloridos (violeta intenso y naranja) y por ende absorberían en la misma zona espectral interfiriendo en la medida.
La razón por la cual se desea que el hierro se mantenga en Fe (III), es debido a que el Fe (III) es capaz de formar complejos octaédricos colorados y absorben en el rango visible, por otro lado, el Fe (II) no forma complejos octaédricos y requiere mucha más energía para lograr una transición electrónica, generando en cuestión una menor longitud de onda y por ende se desplazaría a la zona UV creando poco color en el rango visible. El Fe (+3), tiene cinco electrones libres, en los cinco orbitales atómicos del tipo d, mientras que el Fe(+2), tiene un par de electrones en un orbital d y cuatro desapareados.
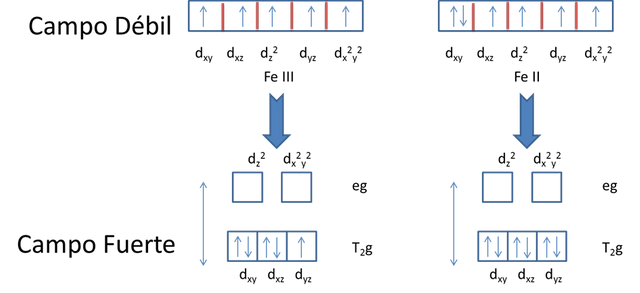
Distribución de los electrones en los orbitales-Fuente: @VianniS
Si los ligandos involucrados con el metal presentan un campo débil, inducen un desdoblamiento, y como consecuencia el complejo será de alto espín. Sin embargo con ligandos que tienen un campo fuerte, es decir, los ligandos que interaccionan con el elemento central, estos electrones se encuentran en los tres orbitales de menor energía, quedando un electrón desapareado en el Fe (+3) como se muestra en la figura anterior.
En el caso de esta experiencia se introduce un ligando de campo débil, debido a que estos ligandos son característicos por ser coloridos, utilizando el tiocianato (a diferencia del hidroxilo, ligando fuerte), este ligando débil forma un complejo con el Fe(III) de color rojo sumamente intenso, cuya reacción es la siguiente:

Reacción involucrada- Fuente: @VianniS
Este complejo absorbe alrededor de los 470-510 nm, para garantizar su formación es necesario añadir una cantidad ligeramente en exceso de tiocianato (ya que el Fe (III) es el elemento limitante en la reacción) a una concentración especifica que garantice la adición de los 6 moles de tiocianato necesarios para la constitución completa del complejo, que en este caso fue de 0,1 M.
Otras de las razones de porque se empleó ácido nítrico y ácido clorhídrico es por su alta solubilidad y por ser ligandos mucho más débiles que el tiocianato, y por tanto no podrían desplazarlo en la formación del complejo. Por otro lado no se utilizaron ácidos orgánicos debido a que formarían complejos con el hierro evitando la formación del complejo con el tiocianato y por tanto se arruinaría el método.
Puede que durante el tratamiento de la muestra de harina pudieran estén presente algunos metales capaces de interferir en la lectura de las absorbancias como el cadmio, mercurio y zinc estos tienen la habilidad de formar complejos solubles con el reactivo y podrían minimizar la intensidad del color. Por otro lado, tenemos que si el ácido nítrico se encuentra en altas concentraciones es de color ámbar el cual se solaparía con el color del complejo con el hierro.
Al proceder a la determinación de la concentración, conjuntamente con la cantidad en gramos del hierro en las dos muestras de harina tratadas, se utilizó la ecuación de la recta de cada una de las curvas de calibración para cada equipo, sustituyendo el valor de “Y” correspondiente a la absorbancia detectada por cada equipo y sustituyendo las pendientes e intesectos correspondientes a cada recta, logrando así la determinación de la concentración de hierro en las muestras de harina, cuyos resultados se muestran en las tablas 4 y 5; y cuyos cálculos se muestran a continuación.
Cálculos pertinentes

Referencias
- Alonso Sierra isabel,zarcero lorante sonia,ourtahuella perez daman,experimentacion en quimica analitica;servicion de publicaciones madrid 20.
- seminario internacional sobre la señalada de ecologia y suelos en la facultades de agronomia,universidad de costa rica, 6-12 de agosto de 1967, organizado por CA.zona norte guatemala ,GA.
4.http://www.ciens.ucv.ve:8080/generador/sites/LIApregrado/archivos/Guia%20Foto%20Modificacion%20mayo%202013-2.pdf
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por el apoyo brindado en todos mis post.
Muy bien desarrollado @viannis. Excelente la aplicación del método para la determinación de hierro, muy acertada la aplicación para el control de calidad de los alimentos, la química y la espectrometría tienen un gran campo de aplicación en esta área.
Hola @miliomoron Gracias por estar pendiente de mis post.
Muy buen artículo estimada @Viannis! Bastante detallado. Te recomiendo que en los artículos siempre aclares el origen de todas las imágenes utilizadas. Hay varias que usas como figuras y tablas, pero son imágenes estrictamente hablando. Aunque se puede inferir que son tuyas, por favor señálalo explícitamente y si puedes especificar una licencia para ellas, mejor. Saludos! :D
Hola @eniolw olvide aclararlo al final. Todas las imágenes son de mi autoria.
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Congratulations @viannis! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard: