La magia de la Catálisis
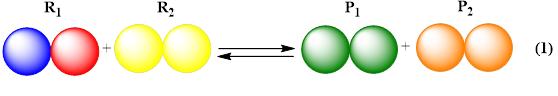
Una reacción química es un proceso de transformación donde una o más sustancias químicas, llamadas reactantes (R1, R2), sufren cambios para originar otras sustancias químicas, los productos (P1, P2), tal como se muestra en la ec. 1. Todas las reacciones químicas pueden visualizarse como equilibrios, unas dirigidas casi en su totalidad hacia los productos, otras dirigidas hacia reactantes (no espontaneas) y las que están en equilibrio propiamente dicho.
La posición de equilibrio está dada por parámetros termodinámicos, en especial por la energía libre, la cual nos dice cuán factible es que los reactantes se puedan convertir en productos. Por conveniencia, se habla en términos de la energía libre estándar (ΔG°), que es aquella energía necesaria para que se forme un compuesto a partir de sus elementos, cuando tanto reactantes como productos están en su estado estándar (25°C y 1 atm. de presión). Para que la reacción sea termodinámicamente factible, el ΔG° de la misma deberá tener un valor muy negativo (la energía libre de los productos es menor que la de los reactivos).
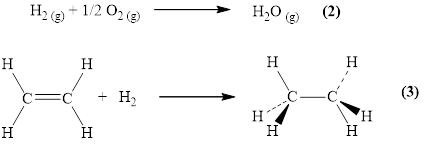
En el equilibrio, ΔG° = -RT ln Kp, donde Kp es la constante de equilibrio expresada en términos de presiones parciales. Por ejemplo, para la reacción de formación de agua a partir de un mol de hidrógeno y medio mol de oxígeno (ec. 2), tanto el ΔG° (-228 KJ/mol) como el Kp (1.19 x 1040 atm-1/2) indican que el equilibrio está desplazado hacia la derecha (hay un predominio de los productos sobre los reactantes). Sin embargo, si se mezcla hidrógeno y oxígeno no ocurre nada, al menos que se adicione platino finamente dividido. Similarmente, para la reacción de hidrogenación de etileno a etano (ec. 3) sucede algo similar ( ΔG° = -101 KJ/mol y Kp = 5.16 x 1017 atm-1); la reacción solamente procede si se coloca pequeñas cantidades de un compuesto como RuHCl(PPh3)3.
El platino finamente dividido y el compuesto RuHCl(PPh3)3 son como “polvos mágicos” que permite que la reacción correspondiente proceda; estas sustancias reciben el nombre de catalizador; el mecanismo a través del cual se acelera la reacción se denomina catálisis. Un catalizador se define como una sustancia, la cual no son alteradas irreversiblemente, que incrementa la velocidad con la cual se alcanza un equilibrio, pero sin modificarlo.
Si se tiene una reacción que sea factible termodinámicamente y la reacción no se da, entonces ¿cómo funciona un catalizador? Este actúa buscando alternativas de baja energía para formar los productos. La efectividad de un catalizador viene dada por la diferencia de energía de activación entre el proceso catalizado y el mismo proceso sin catalizar (Figura 1). Lo que afecta la velocidad de reacción es disminuir la energía de activación del intermediario del paso lento del proceso. La energía de activación (Ea) de una reacción se puede definir de manera sencilla como la diferencia de energía entre la barrera alta de energía más y la energía de los reactantes.
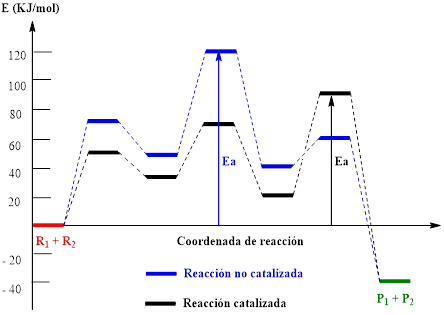
Los procesos que involucran un cambio de energía libre altamente positivo indican que no es conveniente buscar un catalizador. En términos prácticos, se puede establecer que si el ΔG° < 0 la reacción es prometedora, si el ΔG° está entre 0 y 40 KJ la reacción es dudosa, pero podría valer la pena buscar un catalizador, pero si, por el contrario, el ΔG° es mayor de 40 KJ/mol no se justifica buscar un catalizador para la reacción.
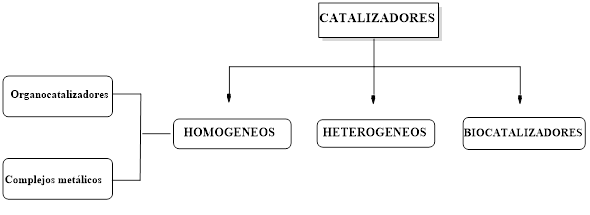
Desde el punto de vista químico, los sistemas catalíticos se clasifican en heterogéneos y homogéneos (Figura 2). La catálisis heterogénea es aquella en la cual el catalizador (metal u óxido metálico soportado sobre un material inerte como alúmina ó sílica) se encuentra en estado sólido, mientras que los reactantes y productos están en fase líquida o gaseosa. En la catálisis homogénea tanto los reactantes, los productos y el catalizador se encuentran en la misma fase (usualmente en solución); entre los catalizadores homogéneos se encuentran los organocatalizadores y los complejos de metales. Existe un tercer tipo de catalizadores, las enzimas, también denominadas biocatalizadores, que son aquellos que tienen los seres vivos dentro de cada una de sus células.
Las primeras dos filosofías están ejemplificadas por el platino finamente dividido (catalizador sólido heterogéneo) en la reacción en fase gaseosa entre el hidrógeno molecular y el oxígeno, y por el complejo RuHCl(PPh3)3 (catalizador homogéneo); en este último caso, el complejo, el etileno y el hidrógeno se disuelven mediante el uso de un compuesto orgánico líquido (solvente), de tal manera que las fracciones de etileno y de hidrogeno que reaccionan son aquellas que se encuentran disueltas en el medio de reacción.
La catálisis heterogénea presenta algunas ventajas que le han permitido poseer aplicaciones a nivel industrial, entre las cuales se puede mencionar la facilidad de separación del catalizador de los productos y por ende su respectiva reutilización. Entre las ventajas de la catálisis homogénea se pueden mencionar las altas actividades catalíticas y selectividades obtenidas bajo condiciones de temperatura y presión más suaves que la de los procesos catalíticos heterogéneo. La ventaja imbatible de la catálisis homogénea con complejos de metales de transición es, sin lugar a dudas, la estructura molecular normalmente bien definida combinada con la variabilidad de estructuras de los catalizadores; es por lo tanto posible diseñar catalizadores “a la medida” para una reacción química; esto hace que sea posible modificar la estructura del catalizador y por lo tanto tener la facilidad de estudiar la reacción en más detalle. Entre las desventajas se encuentran la dificultad para una separación efectiva del catalizador de los productos de reacción y su baja estabilidad térmica (T < 200ºC) comparada con la de los catalizadores heterogéneos.
Para finalizar, es necesario definir dos términos: actividad catalítica y selectividad. La actividad catalítica de un sistema se define como una medida de la capacidad y la eficiencia de un catalizador para realizar la transformación deseada. Las unidades más comunes de la actividad catalítica son el porcentaje de conversión de un sustrato a un tiempo determinado, el “turnover number” (TON, que es la cantidad de sustrato convertido por cantidad de catalizador), la frecuencia catalítica (turnover frequency, TOF = TON/unidad de tiempo) y la velocidad de reacción.
En cuanto a la selectividad, este término se emplea para describir la preferencia para obtener un producto determinado cuando existe la posibilidad de obtener varios productos; cuando la selectividad es superior al 95 % se dice que la reacción es específica. Por ejemplo, en la reacción de la ec. 1, se generan dos productos, P1 y P2. Si un catalizador permite formar uno de ellos en mayor proporción que el otro, se dice que el catalizador es selectivo hacia la formación de ese producto.

Referencias Bibliográficas

- J. Hagen, Industrial Catalysis: A Practical Approach, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany, 2006.
- S. Bhaduri, D. Mukesh, Homogeneous Catalysis: Mechanisms and Industrial Applications, Wiley-Interscience, New York, 2014.
@cheetah bite you, Need help?
You must read the articles about steemit help
Why do you upvote in your post's comments?
Want to grow your account ? Maintain some Rules.
All about steemit
Using Header Tage on your post
How to Get Bold and Italic Text for Posting
If my artcles are helpful then follow me
¡Excelente post! Saludos.
Muy buen contenido, me gusta mucho esta área, soy estudiante del Dr. Merlín Rosales y bueno hijo también saludos, en unos días estaré publicando la segunda parte de mi post es muy interesante es algo nuevo en lo que estoy trabajando en conjunto con la Dra. Inés Pacheco y el Dr. Merlin
Buen post, lo entendí todo porque trabajé en catálisis heterogénea para mi tesis de grado, por lo que veo que está bien explicado. Le quisiera pedir un favor, cómo hace para colocar los índices y los subíndices al escrito? Hice mi primera publicación ayer para stem-espanol y como químico me sentí mal al colocar cosas tipo Ca+2 así tal cual, pensaba que el borrador no lo permitía. Un saludo y éxitos en Steemit.
Muchas gracias por el comentario, pronto estaré publicando más contenido de esta área. Yo he trabajado con catálisis homogénea y bifasica, la catálisis heterogénea la he usado para efectos de comparación, por acá estoy a la orden para lo que requieras. Para poner los índices entras en la parte de raw html y colocas si es superíndice primero el Ca luego pones sup dentro de <> luego pones el +2 y al final de todo colocas /sup dentro de <>. Para los subíndices es lo mismo pero en vez de sup, usas sub. Saludos