ESTUDIO DE LA PERMEABILIDAD SELECTIVA DE LA MEMBRANA PLASMÁTICA DE LOS ERITROCITOS DE MAMÍFERO: USO DEL ETILENGLICOL Y DEL SULFATO DE SODIO COMO SOLUTOS DE PRUEBA.
Introducción:
En términos fisicoquímicos las células son definidas como sistemas abiertos, ya que intercambian materia y energía con el medio ambiente. Ellas requieren nutrientes del exterior y deben eliminar sustancias de desecho procedentes del metabolismo, manteniendo así su medio interno estable. Este intercambio se da a través de la membrana plasmática, que es una estructura dinámica y fluida formada principalmente por fosfolípidos y proteínas. No solo define los límites de la célula, sino que además permite que ésta exista como una entidad diferente de su entorno, regulando el tránsito de sustancias hacia el exterior y el interior de ella.
La membrana plasmática posee cuatro características principales: fluidez, asimetría, capacidad de rehacerse y permeabilidad selectiva. La permeabilidad selectiva de las membranas permite el transporte de moléculas e iones a favor (transporte pasivo) o en contra (transporte activo) de su gradiente de concentración. El desplazamiento de dichas moléculas se da de manera espontánea desde regiones donde están más concentradas hacia regiones donde su concentración es menor.
El agua tiende a moverse a través en una membrana semipermeable desde una solución de baja concentración de soluto (hipotónica) hacia una de alta concentración (hipertónica), impulsada por el gradiente de potencial químico en un proceso denominado ósmosis. Una solución isotónica es aquella que no modifica el volumen de una célula inmersa en esa solución.
El eritrocito es una célula sanguínea en forma de disco bicóncavo, con una depresión central y desprovista de organelos en los mamíferos. Son los transportadores por excelencia de O2 y son además los principales responsables de la viscosidad de la sangre. Casi todo el volumen del eritrocito maduro consiste en hemoglobina, la hemoproteína a la que se unen las moléculas de O2.
Al colocar eritrocitos en soluciones hipertónicas, las altas concentraciones de solutos hacen que el agua abandone la célula, haciendo que ésta se contraiga en un proceso llamado crenación. Con el tiempo, van entrando las moléculas presentes en la solución hipertónica, aumentando el número de moléculas osmóticamente activas dentro de la célula, con lo que se absorbe además una cantidad correspondiente de agua.
La membrana celular solo puede extenderse por la entrada de agua hasta cierto punto sin que sus propiedades sufran grandes modificaciones. Si se sobrepasa el límite de extensión celular, la membrana se vuelve suficientemente porosa para permitir que las moléculas de hemoglobina abandonen la célula en un proceso denominado hemólisis. Este proceso ha sido utilizado para medir la velocidad de penetración de las sustancias en eritrocitos a partir del tiempo que tarde en presentarse la hemólisis.
Objetivos:
El siguiente trabajo tiene como finalidad reconocer a la membrana plasmática como la principal estructura involucrada en los procesos biofísicos básicos involucrados en el intercambio de materiales entre la célula y su medio ambiente, mediante la utilización de células sanguíneas (eritrocitos).
Procedimiento experimental:
1. CALIBRACIÓN DEL ESPECTROFOTÓMETRO (Longitud de Onda: 500 nm):
a) Se prepararon dos soluciones de eritrocitos de conejo, una 100% de hemólisis y otra 0% de hemólisis.
Suspensión 100% de hemólisis: Se tomaron 0,5 ml de la suspensión de eritrocitos y se hemolizó con 10 ml de agua destilada. Se completó hasta un volumen de 30 ml usando solución salina hipertónica (NaCl 258 Mm).
Suspensión 0% de hemólisis: Se tomaron 0,5 ml de suspensión de eritrocitos y se añadió solución salina isotónica (NaCl 150 mM) hasta un volumen final de 30 ml.
b) Se colocaron 6 ml de cada una de las suspensiones preparadas en la parte anterior en cubetas Bausch & Lomb para fotocolorímetro. Se midió el blanco (suspensión 100% de hemólisis).
c) Se midió la densidad óptica de la suspensión 0% de hemólisis y se anotaron los resultados.
1a. CONSTRUCCIÓN DE UNA CURVA DE CALIBRACIÓN:
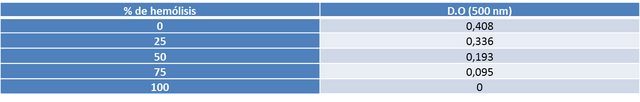
a) Se mezclaron con cuidado las suspensiones de 0% y 100% de hemólisis. Se prepararon suspensiones con un 25, 50 y 75% de hemólisis con un volumen final de 6 ml en cada suspensión (ver tabla 1).
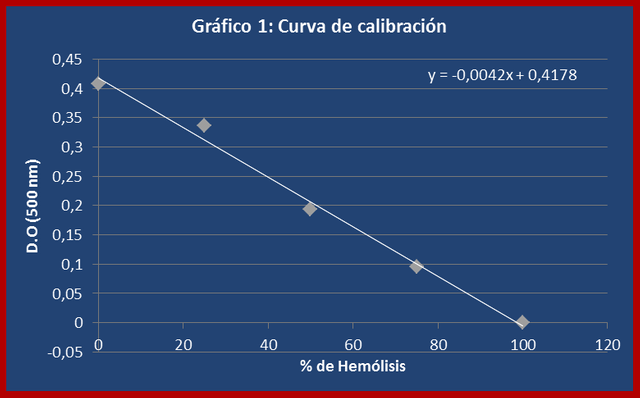
b) Se leyeron las correspondientes densidades ópticas y se construyó la curva de calibración (ver gráfico 1).
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
2. CONSTRUCCIÓN DE UNA CURVA DE FRAGILIDAD DE LOS ERITROCITOS:
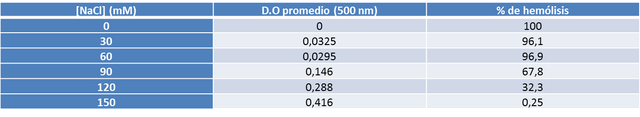
a) Se prepararon soluciones de NaCl con las siguientes concentraciones finales: 0, 30, 60, 90, 120, 150 mM; partiendo de una solución madre de NaCl 150 mM. Ver tabla 2.
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
b) Se rotularon 12 tubos con duplicado incluido, y se colocó en estos tubos 5,9 ml de cada solución de NaCl preparada, luego se añadió 0,1 ml de suspensión de eritrocitos y se mezcló por inversión dejando en reposo por 10 minutos.
c) Al transcurrir los 10 minutos, se midió la densidad óptica.
d) Utilizando la curva de calibración, se determinó el porcentaje de hemólisis en cada tubo.
e) Se graficó la curva de fragilidad.
3. ENSAYO DE PERMEABILIDAD SELECTIVA DE LA MEMBRANA DE LOS ERITROCITOS:
3a. Procedimiento para la determinación cualitativa (método visual):
En una placa de microtitulación de 96 pocillos, se colocó una gota de sangre de conejo lavada y 4 gotas de cada soluto. Se colocó un papel debajo a fin de poder leer las letras. Dependiendo del tiempo que tardaron los solutos en entrar a los eritrocitos se clasificaron de la siguiente manera:
• Solutos rápidos: Si el tiempo de hemólisis es menor o igual a 2 minutos.
• Solutos intermedios: Si el tiempo de hemólisis se encuentra entre 2 y 7 minutos.
• Solutos lentos: Si el tiempo de hemólisis es superior a 10 minutos.
3b. Procedimiento para determinación cuantitativa:
Se colocó en un tubo de Bausch & Lomb 5,9 ml del soluto (sulfato de sodio) y 0,1 ml de la suspensión de eritrocitos. Se leyó la D.O en el espectrofotómetro siguiendo las siguientes indicaciones:
• Para solutos lentos: Lectura inicial en el tiempo 0, 3 lecturas de densidad óptica cada 5 minutos y luego lecturas cada 10 minutos hasta llegar al 100% de hemólisis.
Resultados:
1a. CONSTRUCCIÓN DE UNA CURVA DE CALIBRACIÓN:
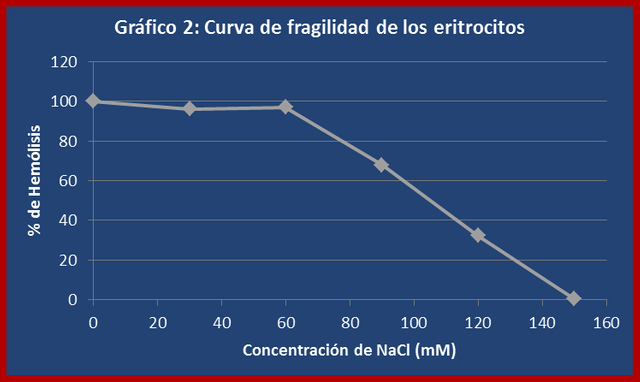
2. CONTRUCCIÓN DE UNA CURVA DE FRAGILIDAD DE LOS ERITROCITOS:
Usando la ecuación Y = (-0,004)X + 0,417 se halló el % de hemólisis asociado a cada concentración de NaCl. Al despejar X se obtiene: X = (Y - 0,417) / -0,004, sustituyendo Y por el valor de D.O promedio se obtiene el % de hemólisis.
3. ENSAYO DE PERMEABILIDAD SELECTIVA DE LA MEMBRANA DE LOS ERITROCITOS:
3a. Determinación cualitativa (método visual):

3b. Determinación cuantitativa:
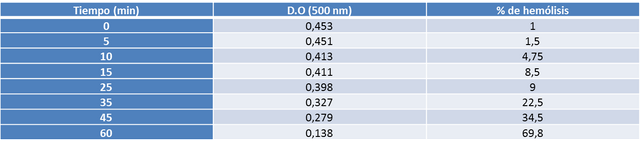
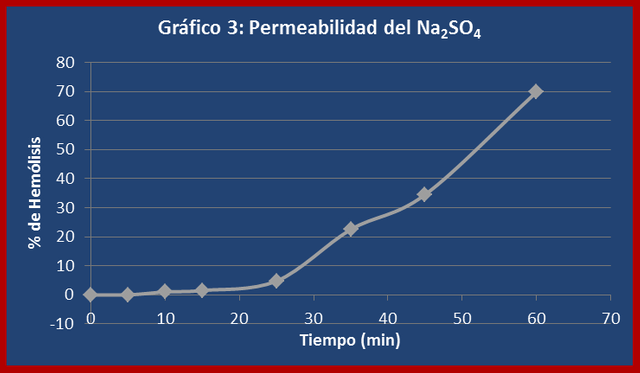
Discusión:
La curva de calibración permitió obtener los valores de densidad óptica asociados a las suspensiones de eritrocitos cuyos porcentajes de hemólisis eran conocidos, con la finalidad de evaluar la tendencia de estas variables. Los valores hallados experimentalmente corresponden a los reportados en la bibliografía, donde la densidad óptica y el porcentaje de hemólisis establecen una relación inversamente proporcional, en la que a medida que el porcentaje de hemólisis aumenta la densidad óptica disminuye (ver gráfico 1). Los datos obtenidos en esta experiencia permitieron hallar la ecuación de la recta mejor adaptada a los puntos generados, con el fin de establecer una relación matemática confiable entre las densidades ópticas de las suspensiones utilizadas en las experiencias siguientes y sus porcentajes de hemólisis, cuyos valores se desconocían.
El fenómeno físico que permite explicar esta relación es que cuando ocurre la hemólisis de los eritrocitos por ruptura de la membrana plasmática se produce un cambio en el Índice de refracción (η) entre el interior celular (ηi) y el de la solución externa (ηe). Inicialmente estos índices son diferentes y al producirse la hemólisis se mezclan ambos ambientes (interno y externo) de modo que ηi = ηe. Este cambio puede ser monitoreado haciendo incidir un rayo de luz sobre la preparación en un espectrofotómetro, midiendo así la dispersión de luz que ocurre por el pasaje de los rayos por medios de diferentes η.
Cabe destacar que las lecturas espectrofotométricas se realizaron a 500 nm, que corresponde a la longitud de onda donde la hemoglobina presenta menor absorbancia.
La curva de fragilidad permitió evaluar la resistencia de los eritrocitos a la presión osmótica ejercida por una serie de soluciones hipotónicas respecto al medio intracelular. Los valores obtenidos en esta experiencia corresponden a los esperados teóricamente donde el porcentaje de hemólisis disminuye a medida que la concentración de soluto (NaCl) aumenta (ver gráfico 2). La membrana celular permite el paso de moléculas de agua y de todos los solutos permeables hasta que se igualen sus respectivos potenciales químicos a ambos lados de la membrana. No obstante, existe un gran número de especies, tanto en el fluido que rodea la célula como en el fluido celular o citoplasma, que no pueden atravesar la membrana. Si la concentración total de este soluto es más grande en el fluido que rodea la célula, ésta perderá agua por ósmosis, y se dice que el fluido circundante es hipertónico respecto al fluido celular (tiene mayor presión osmótica). En caso contrario, cuando la concentración total del soluto que no puede atravesar la membrana es mayor en el fluido de la célula,
ésta ganará agua del líquido hipotónico circundante (de menor presión osmótica). Cuando no se produce transferencia neta de agua entre el fluido celular y el que rodea la célula, se dice que los dos fluidos son isotónicos, es decir, tienen la misma presión osmótica.
Hay que destacar que para este ensayo de utilizó un población de eritrocitos heterogénea respecto a su vida media. En la mayoría de los vertebrados los eritrocitos poseen una vida media de aproximadamente 120 días, tiempo durante el cual se producen una serie de cambios físicos y metabólicos a medida que las células envejecen. Estos cambios impactan especialmente en la capacidad de la membrana plasmática de soportar grandes presiones osmóticas, por lo que en general puede decirse que los eritrocitos con una vida media prolongada presentarán una mayor fragilidad a los cambios osmóticos que experimenten.
Con tiempo suficiente, casi cualquier molécula acabará difundiendo a través de la bicapa lipídica a favor de su gradiente de concentración. Sin embargo, la velocidad de difusión varía en gran medida. Dependiendo en parte del tamaño de la molécula y de su solubilidad relativa en aceite (coeficiente de partición). En general, cuanto menor es la molécula y cuanto más apolar es, más rápidamente difunde a través de la bicapa (ver figura 1). Las moléculas que pueden atravesar con facilidad las membranas celulares, debido al fenómeno de difusión simple, son únicamente las de los gases, las moléculas hidrofóbicas y las moléculas polares pequeñas. Esto es así debido a que las moléculas hidrofóbicas y apolares son solubles
en la región central apolar de la bicapa lipídica, y las moléculas polares pequeñas son lo suficientemente pequeñas como para que las interacciones desfavorables se vean compensadas por un aumento de la entropía del sistema. Por otra parte, las moléculas polares grandes y las moléculas cargadas o iones establecen interacciones demasiado fuertes con el medio acuoso fuera de la bicapa lipídica, por lo que les resulta muy desfavorable desde el punto de vista energético romper estas interacciones para atravesar la región central hidrofóbica. Como consecuencia las membranas biológicas son prácticamente impermeables a este tipo de moléculas, por lo que requieren de otros mecanismos de transporte.
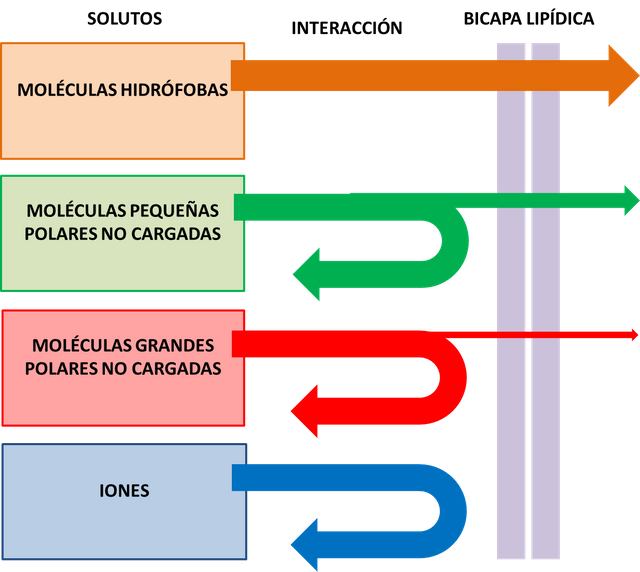
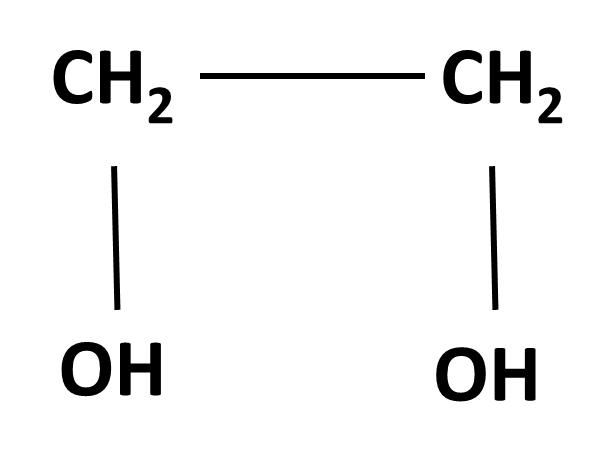
En el caso del etilenglicol la velocidad de difusión fue muy rápida, provocando un 100% de hemólisis en aproximadamente un minuto. Este comportamiento en la cinética de difusión de este compuesto se debe principalmente a su pequeño tamaño y a su relativamente elevado coeficiente de partición. Estructuralmente el etilenglicol pertenece a la familia de los dioles, que se caracterizan por contener dos grupos hidroxilos en sus extremos. La presencia de estos grupos polares le otorga cierta afinidad por el agua, por lo que su miscibilidad en ella es bastante elevada, pudiéndose mezclar en cualquier proporción. Sin embargo la presencia de cadenas hidrocarbonadas centrales le permite interactuar en mayor proporción con las regiones hidrofóbicas de la bicapa lipídica, pudiéndose solubilizarse en ésta y entrar a la célula con relativa facilidad (ver figura 2).
Por el contrario las bicapas lipídicas son muy impermeables a todas las moléculas cargadas, por muy pequeñas que sean. La carga y el elevado grado de hidratación de estas moléculas les impiden penetrar en la fase hidrocarbonada de la bicapa.
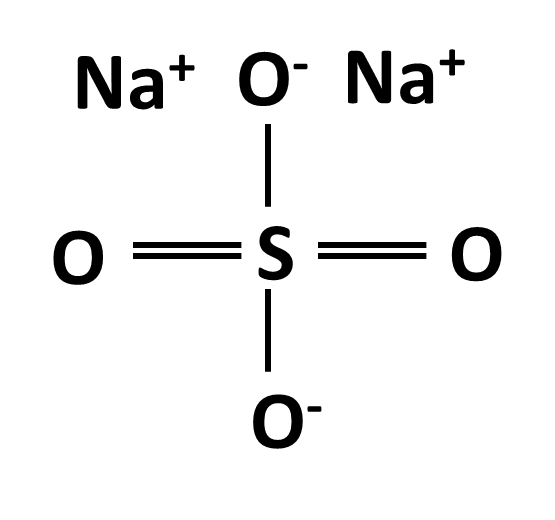
En el caso del sulfato de sodio la velocidad de difusión fue muy lenta, tardando aproximadamente una hora en provocar un 50% de hemólisis (ver gráfico 3). Cuando el sulfato de sodio está en solución acuosa se encuentra disociado en sus iones componentes (sodio y sulfato) alrededor de los cuales se forma una gran capa de solvatación debido a la fuerza electrostática entre el núcleo de éstos y las moléculas de agua (ver figura 3). Esta alta afinidad por el agua le confiere al sulfato de sodio un coeficiente de partición muy pequeño, que lo hace completamente impermeable a la membrana celular. Por otra parte el tamaño del ión sulfato también dificulta su entrada a la bicapa lipídica. Sin embargo la gráfica de permeabilidad de este soluto muestra una incorporación progresiva al interior celular, lo cual se explica por la presencia de canales y proteínas transportadoras especializadas que median la entrada de estos iones.
Conclusiones:
Al término de esta práctica de laboratorio hemos podido identificar el papel de la membrana plasmática como la principal estructura involucrada en los procesos biofísicos que rigen el intercambio de materiales entre las células y su medio externo. Además hemos comprendido la utilidad de aplicar estos conceptos básicos en experiencias de laboratorio sencillas y prácticas que permitan entender los procesos fisicoquímicos involucrados en los mecanismos de transporte celular y regulación osmótica, utilizando un modelo clásico y altamente reproducible como el que ofrecen los eritrocitos.
Referencias bibliográficas:
Alberts, B. (2010). Bilogía molecular de la célula. Ediciones Omega. Cuarta Edición. Barcelona, España.
Giese, A. C. (1983). Fisiología Celular y General. Nueva Editorial Interamericana. Cuarta Edición. México.
Lodish, H. (2005). Biología Celular y Molecular. Editorial Médica Panamericana. Quinta Edición. Buenos Aires, Argentina.
Rodak, B. (2005). Hematología: Fundamentos y aplicaciones clínicas. Editorial Médica Panamericana. Segunda Edición. Buenos Aires, Argentina.
Espero que te haya gustado este post. ¡saludos!


Upvote this for me please? https://steemit.com/christianity/@bible.com/verse-of-the-day-hebrews-4-16-nlt
Upvote this for me please? https://steemit.com/christianity/@bible.com/verse-of-the-day-hebrews-4-16-nlt
Congratulations! This post has been upvoted from the communal account, @minnowsupport, by SoyCiencia from the Minnow Support Project. It's a witness project run by aggroed, ausbitbank, teamsteem, theprophet0, someguy123, neoxian, followbtcnews, and netuoso. The goal is to help Steemit grow by supporting Minnows. Please find us at the Peace, Abundance, and Liberty Network (PALnet) Discord Channel. It's a completely public and open space to all members of the Steemit community who voluntarily choose to be there.
If you would like to delegate to the Minnow Support Project you can do so by clicking on the following links: 50SP, 100SP, 250SP, 500SP, 1000SP, 5000SP.
Be sure to leave at least 50SP undelegated on your account.
Excelente amigo @josearmandor, el método científico desde lo experimental mediante la biología celular, interrelacionado con la estructura y maquetado en Steemit. Saludos
Muchas gracias por su comentario y por estar atento a mis publicaciones, saludos cordiales.
Lo has dado todo en este post Amigo. Hemos quedamos impresionados. Saludos.
Muchas gracias por el apoyo del equipo Cervantes, saludos.