Biología y Química de la mano. Procedimiento de laboratorio: Soluciones moderadoras, amortiguadoras o tampón
Hola a todos

Introducción
Saludos para todos los que tiene la oportunidad de esta lectura. En más de una ocasión, se ha resaltado el valor de las estrategias empíricas para el beneficio y la promoción de las ciencias, debido a sus diversas ventajas y que ayudan a numerosos procesos del aprendizaje, como el desarrollo motriz, habilidades para la observación, compresión de aspectos sobre teoría y práctica científica, entre otras. Razones suficientes, para continuar con este tipo de actividades académicas en las aulas, salones, o entornos escolares o académicos. Por ello, para esta ocasión y en la línea de Biología y Química de la mano, voy a presentar de manera concisa un protocolo para la práctica de laboratorio sobre los amortiguadores o soluciones tampón.

Esbozo teórico Parte I
Las soluciones amortiguadoras, disolución reguladora, buffer o tampón, son aquellas que poseen la propiedad de mantener un equilibrio constante con respecto al pH, es decir a sus niveles en determinados medios. Con la adición de pequeñas cantidades de ácidos o bases, por ejemplo, en una concentración de una solución de ácido o base acompañadas con algunas bases o ácidos conjugados al añadir un ácido o base dependiente el caso la concentración o la disolución se ira neutralizando para mantener un pH estable con respecto al medio.
Estas concentraciones de disoluciones tienen una importancia vital, puesto que tienen utilidad para evitar ciertas reacciones. Ejemplo de ello, es que ocurra una modificación en la concentración de iones de hidrógenos de una célula provocando que la actividad enzimática se detenga. Por esto, el pH en los sistemas biológicas es una variable determinante para los funcionamientos y mantenimiento vitales del organismo. De hecho, para el caso de los humanos, la acción de las enzimas y las reacciones químicas dentro de las células están regulados gracias a los tampones biológicas que mantienen en unos márgenes al pH para el funcionamiento celular.

Bajo este contexto, vale resaltar que los amortiguadores biológicos o tampones biológicos son el conjunto de sistemas que ayudan al funcionamiento de un organismo, a través de mantener en constante equilibrio al pH. Es decir, que el valor del pH sea compatible con las características de la vida del organismo. Por ello, los tampones están para regular el metabolismo cuando por ejemplo se genere una concentración muy alta de ácidos. En caso particulares puede desarrollarse algún tipo de desequilibrio y producir alguna enfermedad. Por ejemplo, tenemos los casos de acidosis y alcalosis, en estos casos el pH se está viendo alterado. El primero podría ser por insuficiencia renal, metanol, posiblemente una sustancia toxica, entre otras.
Según algunos autores, los tampones biológicos se clasifican en:
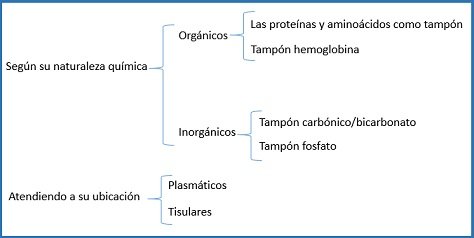
El tampón de bicarbonato está formado por bicarbonato y H2CO3 (ácido carbónico), siendo un regulador de mucha importancia en la sangre, relacionado con la liberación del CO2 a través del sistema pulmonar. Es considerado como un sistema abierto, que a su vez es posible encontrarlo en la parte del líquido intersticial. El tampón o amortiguador de fosfato, a pH fisiológico tenemos el dihidrogeno fosfato y el hidrogeno fosfato. Teniendo un pH próximo al pH plasma y además actúa también en el líquido intersticial. Sus concentraciones con respecto al tampón de bicarbonato son inferiores en la sangre. Tiene mucha eficacia frente en medio ácidos.
Parte II
En los procesos es importante que el pH no se altere o que su variación sea pequeña, a pesar de que se añadan cantidades moderadas de ácidos o de bases. El control sobre el pH lo ejercen las llamadas soluciones moderadoras, amortiguadoras, reguladoras, tampones. Una solución tampón frecuentemente consiste en:
A.- Acido débil y una sal soluble del mismo ácido. Por ejemplo:
- CH3-COOH ácido acético
- CH3-COONa acetato de sodio
B.- Base débil y una sal soluble de la misma base. Por ejemplo:
- NH4OH Amoniaco acuoso
- NH4Cl Cloruro de amonio
En general una solución amortiguadora está compuesta de un ácido (o base) débil y una sal soluble del mismo ácido (o base) y tiene la capacidad de reaccionar tanto con ácidos como con bases. Cómo actúan las soluciones amortiguadoras; en el caso de una solución tampón de ácido acético (CH3-COOH) y acetato de sodio (CH3-COONa) ocurre lo siguiente:
A.- El acetato de sodio está totalmente ionizado de la siguiente manera
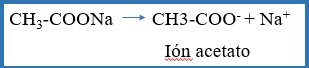
B.- El ácido acético, al ser un ácido débil está parcialmente ionizado y en equilibrio sus iones

Si se añade más ácido a una solución de ácido acético y acetato de sodio, aumenta considerablemente la concentración de H+, provocando una disminución de pH. Pero los iones acetato presentes en gran cantidad reaccionan con los iones H+ (iones hidrogeno) añadidos para formar moléculas neutras de ácidos acético. El pH no bajara considerablemente.
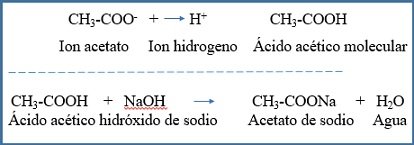
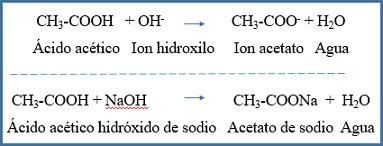
De la misma manera si se añade una base se incrementa considerablemente la concentración de iones OH- (ión hidroxilo) provocando que el pH aumente. Pero al existir una elevada cantidad de ácido acético molecular o no ionizado, los iones OH- son neutralizados formando moléculas de agua. El pH no subirá drásticamente.
Materiales
- Tubo de ensayo
- Cilindro graduado
- Vasos de precipitado
- Agitadores de vidrio
- Vidrio reloj
- Papel indicador universal
- Soluciones de CH3COOH, CH3COONa, HCl, NaOH
Momento de la practica
Primera parte
- Vierte 5 ml de ácido acético 0,5mol/l (CH3COOH) en dos tubos de ensayo. Mide el pH de la solución.
- Vierte 1ml de ácido clorhídrico (HCl) 0,01mol/ en un tubo de ensayo. Mide el pH de la solución.
- Vierte 1ml de hidróxido de sodio (NaOH) 0,01 mol/l en un tubo de ensayo. Mide el pH de la solución .

Para medir el pH: toma una (1) gota de la solución con un agitador de vidrio y moja (humedece) con ella un trozo de papel indicador o pH universal.
Tabla de valores:

Segunda parte
- Vierte el ácido clorhídrico 0,01 mol/l sobre uno de los tubos de ensayo que contiene ácido acético 0,5 mol/l. Agita y mide el pH de la mezcla.
- Vierte el hidróxido de sodio 0,01mol/l. Agita y mide el pH de la mezcla.

Tabla de valores:

Tercera parte
- En un vaso de precipitado vierte 10ml de ácido acético 0,5 mol/l y 10ml de acetato de sodio 0,5mol/l. agita y mide el pH de la mezcla.
- Separa dos porciones de la mezcla y colócalas en dos tubos de ensayo

2.1.- Al tubo número 1 agrega 1ml de ácido clorhídrico 0,01 mol/l. Agita y mide el pH de la mezcla.
2.2.- En el tubo numero 2 agrega 1ml de hidróxido de sodio 0,01mol/l. Agita y mide el pH de la mezcla.

Nota final
Los procedimientos de laboratorios para cualquier tipo de práctica son de suma importancia. No solo por el aspecto de responsabilidades de los estudiantes sino por el tipo de soluciones o muestras que se pueden llegar a trabajar dentro de los estándares científicos. En el campo de la medicina, microbiología, genética, enfermería y otros afines, se debe ser cuidadoso cuando se trabaje. Estas características aportan a los estudiantes una visión correcta de los procedimientos que pueden llevarse a cabo y su repercusión durante la labor profesional.
Referencia bibliográfica y fuente de las imágenes
- Cada una de las imágenes son propias, editadas en power point y paint.
- Khanacademy.org. Ácidos, bases, pH y soluciones amortiguadoras. Consultado: 2018.
- Gálvez. LOS PRINCIPALES AMORTIGUADORES EN EL ORGANISMO HUMANO Y SU IMPORTANCIA EN SU FUNCIÓN REGULADORA.
- Quimitube. Soluciones amortiguadoras en nuestro cuerpo: la sangre. Consultado: 2018
- Túnez y col. pH y amortiguadores: Tampones fisiológicos.
Estas participando para optar a la mención especial, que se efectuará el 12 de Agosto del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Muchas gracias.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Mil gracias por el apoyo.
Excelente post, estimado @hogarcosmico por la importancia de la temática abordada de manera interdisciplinar y didáctica. Se agradecen estos esfuerzos por mostrar esa vinculación entre las áreas afines, particularmente entre la química y la biología. felicitaciones
Así es, gracias por tus apreciadas palabras. Es importante que estas temáticas sean tratadas de forma teórica-práctica.
Tuve la oportunidad de ser su alumno, ahora se que es miembro de esta comunidad y seguiré aprendiendo de usted, un saludo profe Eloy, excelente post, como siempre muy interesante!
Jose Pavón-
Hola, muchas gracias por tus palabras. Esos momentos estarán en mi recuerdo de una manera muy grata. :D Feliz día.