Demostración química de la Electrolisis del Agua para la obtención de Hidrógeno y Oxígeno puro |Área: Reacciones Redox |
Electrolisis del Agua

Electrolisis del Agua:
La definición de la electrolisis del agua es muy simple, pues consiste en un proceso electroquímico, es decir de oxidación y de reducción de uno más elementos que por medio de la inducción de corriente eléctrica se descompone la molécula del agua (H2O), produciendo así hidrógeno y oxígeno gaseoso.
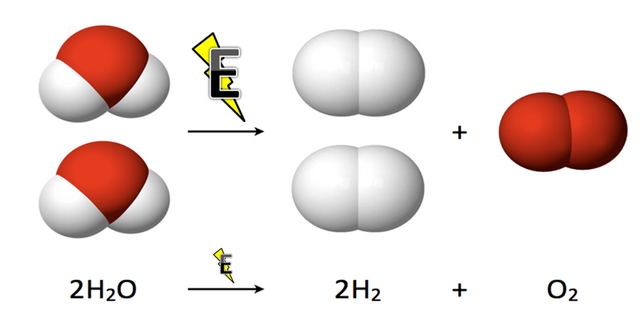
Teniendo así la reacción que deseamos obtener: 2H2O + Energía |produce| 2H2 + O2
Reacción química del Agua
El procedimiento y los materiales a usar son sencillos y fáciles de conseguir. Una fuente de alimentación eléctrica que se conecta a dos electrodos, que por lo general deben estar hechas de un metal inerte como el acero inoxidable o el platino para evitar que reaccionen, en el cual deben estar colocados en el agua. Por otra parte también pueden ser electrodos que tengan afinidad o específicos con lo que se desea hacer. En la celda de hidrógeno el cátodo es el electrodo con carga negativa, y el oxígeno aparecerá en el ánodo con carga positiva.
Por otra parte el agua por sí sola no es muy buena conductora de electricidad y más si es pura, ósea; el agua destilada no es conductora lo que nos llevaría a utilizar un medio electrolítico, que no es más que una solución con altos contenidos de iones para transportar o permitir el paso de la corriente eléctrica al agua, para que así esta se descomponga, o se separe en hidrógeno y oxígeno respectivamente.
Celda electroquímica química del Agua

Sin embargo por ser un sistema abierto se nos dificulta atrapar los gases liberados, lo cual estaré implementando un sistema casero para atraparlos y medir su volumen y así comprobar que la teoría complementa la práctica cuando nos referimos a la reacción el cual, la relación esta 2:1, que por cada dos moléculas de hidrógeno liberado sale un molécula de oxígeno. Los que nos tiene que quedar con el doble de volumen que el oxígeno.
Materiales y reactivos a utilizar:
• Cuba de vidrio.
• Tornillos de acero inoxidable.
• Cables de corriente.
• Cargador de celular.
• Inyectadoras.
• Agua.
• Sosa caustica.
Como ya les había mencionado por el cátodo se recogerá el hidrógeno y por ánodo el oxígeno, es importante mencionar que usar otra solución electrolítica que no sea el NaOH Sosa caustica (Hidróxido de Sodio), como por ejemplo otro electrolito que tenemos en casa como lo es el NaCl sal común (Cloruro de Sodio), presenta un inconveniente como lo es la reacción del Cloro ya que también liberaría el Cloro gaseoso siendo este toxico, y una impureza para los productos que deseamos obtener.
Proceso de la Electrolisis del agua y la obtención del Hidrógeno y Oxígeno gaseoso :
• Uno de los objetivos principales era obtener los gases por medio de la electrolisis, y demostrar que la reacción química planteada 2H2O + Energía |produce| O2 + 2H2 se diera en la experiencia práctica es decir; que de verdad salieran por cada dos moléculas de hidrogeno se obtuviera una de oxígeno. Y de hecho al final la práctica se recolecto 20 mililitros de hidrogeno y 10 mililitros de oxígeno, lo cual cumple con la teoría de estar a la proporción 2:1. Que por medio de la ecuación de gases ideales P.V= nRT (P= presión, V= volumen, R= constante de los gases, T= temperatura y n= los moles que deseemos calcular), se calcula los moles obtenidos.
Hidrógeno y Oxígeno gaseoso obtenido:

• Obtenemos la reacción química real en base a los moles obtenidos:
0.001215H2O + Energía |produce| 0.000405O2 + 0.00081H2
Que por cada 0.001215 moles de agua que se procesó racionaron para formar 0.00081 moles de Hidrógeno y 0.000405 moles de oxígeno. En lo que equivale en peso a:
0.81 mg de Hidrógeno gaseoso.
6.48 mg de Oxigeno gaseoso.
• Por ser el oxígeno más pesado que el hidrógeno se obtuvo más masa aunque molecularmente es la mitad de hidrógeno obtenido.
Es hermosa la química que nos rodea, y ver desde otro punto de vista que el agua que tomamos puede ser separada con tal facilidad, que nos enseña que la vida es sostenida por dos elementos increíbles de la ciencia.
Hasta la próxima
Selfie con el experimento

Bibiografia
Pagina web: Electrolisis del agua
http://cienciaexperimental.foroactivo.com/t5-electrolisis-del-agua
Quimica General – Raymond Chang, 7 editions.
https://veroaguilazenteno.files.wordpress.com/2011/08/quimica-general-raymond-chang.pdf
Excelente demostración con materiales sencillos amigo @eleonardo
gracias compañero! si se puede hacer fácil en casa. saludos cualquier cosas si tienes duda déjamelas por aca.
Maravillosa demostración, que seria de nosotros sin la ciencia jeje
seria todo magia jajaja saludos ana gracias por pasar a leer el articulo.
De nada de verdad tu trabajo es excelente me gusta mucho
Saludos @eleonardo. Excelente manera de mostrar la electrólisis del agua para obtener sus componentes fundamentales. Buena practica.
gracias hermano @cuarzo05 si fue una practica que suelo disfrutar mucho! a veces me pongo a inventar con eso para llenar globos con hidrógeno! jajaja pero no es facil
Buen aporte a la comunidad @eleonardo
Una demostración didáctica que ilustra sobre protocolos interesantes para evidenciar la importancia práctica de la química. Felicitaciones.
Nota: En cuanto al video, aunque no pude escuchar el audio, queda claro con las escenas las evidencias del proceso. Éxitos.
jjaja no amigo no tiene audio lo hice sin hablar para hacerlo por escrito gracias por pasar siempre a leer mis artículos! y por tus comentarios alentadores que motivan a seguir publicando contenido de buena calidad.
Hermanazo que genial publicación de verdad que si y lo mejor fue el vídeo donde evidenciaste todo el proceso químico, seria genial poder observar todo a nivel molecular creo que abriría mi mente a otros mundos.
gracias hermano por el comentario de verdad que animas a cualquiera! jajaja si seria genial ver todo a nivel molecular a simple vista! saludos compa!
Excelente men me gusto mucho y facil ,explicado excelente