DIAGRAMA DE FASES
1.- Conceptos básicos
a.- Sistema de aleación: Un sistema de aleaciones es la unión de dos o más metales en todas sus combinaciones posibles, es decir, considerando todas las concentraciones posibles del metal A con el metal B.
b.- Fase: Es toda porción de un sistema con la misma estructura o arreglo atómico, con aproximadamente la misma composición y propiedades en todo el material que la constituye y con una interfase ( superficie de separación entre fases) definida por otra vecina.
c.- Componente: Se refiere al tipo de material que puede distinguirse de otro por su naturaleza de sustancia química diferente. Por ejemplo una solución es un sistema homogéneo (una sola fase) pero sin embargo está constituida por al menos dos componentes, es decir por ejemplo el cobre y el níquel son tan similares en naturaleza que son por completo solubles entre sí en toda porción de aleación, para este sistema hay una fase, una solución sólida, y dos componentes que son el Cu y el Ni. Para sistemas de materiales que involucran compuestos en lugar de elementos, los compuestos pueden ser componentes.
d.- Solubilidad limitada: Uno de los componentes se pueden disolver hasta cierto límite en el otro. Se producen dos o más fases sólidas. El ejemplo es mezclar sal con agua. El cobre y el zinc tienen solubilidad limitada.
e.- Solubilidad ilimitada: Se produce una fase sólida. El ejemplo es mezclar agua con alcohol. El cobre y el níquel tienen solubilidad ilimitada.
f.- Ley de Gibbs: ( Josiah Willard Gibbs 1839-1903, físico estadounidense), la ley de Gibbs también llamada la regla de fases, permite calcular el número de fase que pueden coexistir en equilibrio en cualquier sistema, su expresión matemática esta dada por:
P + F = C + 2
Donde:
C: es el número de componentes del sistema.
P: es el número de fases en equilibrio.
F: números de grados de libertad del sistema ( variables : presión, temperatura, composición).
2: corresponde a las variables de temperatura T y presión P.
Si se aplica la regla de fases de Gibbs al diagrama de fases P-T del agua pura (figura 1):
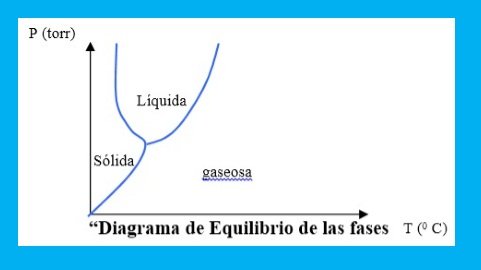
Figura1:Fuente: Propia
Teniendo en cuenta que en el punto triple coexisten tres fases en equilibrio y que hay un solo componente en el sistema (agua), se puede calcular el número de grados de libertad:
P+F= C+2
3 + F = 1 +2
F = 0 ( cero grados de libertad)
Esto quiere decir que ninguna variable ( P:presión,F: fase,C:composición) se puede variar para mantener la coexistencia de las tres fases; en este caso el punto triple se denomina punto invariante.
Si se considera un punto de la curva de solidificación sólido-líquido, en cualquier punto de la línea coexisten 2 fases:
P + F = C + 2
2 + F = 1+2
F=1 ( un grado de libertad)
Este resultado indica que hay un grado de libertad y por lo tanto se puede cambiar una variable independientemente y mantener un sistema con dos fases coexistentes.
El grado de libertad ( o varianza), es el número de variables intensivas que pueden ser alteradas independientemente y arbitrariamente sin provocar la desaparición o formación de una nueva fase. Variables intensivas son aquellas independientes de la masa: presión, temperatura y composición. También se define con el número de factores variables.
F = 0 indica invariante
F= 1 univariante
F= 2 bivariante.
g.- Diagrama de Fases:
Un diagrama de fase es un esquema que muestra las fases y sus composiciones en cada temperatura y composición de la aleación. Cuando en la aleación sólo están presentes dos elementos se puede elaborar un diagrama de fases binario. Cada fase tiene una composición expresada en porcentajes de cada uno de los elementos, expresado en peso. El diagrama de fases es muy útil cuando se desea saber que fases están presentes a cierta temperatura, en el momento de diseñar un proceso de fabricación para un producto metálico. De los diagramas de fases se puede obtener la siguiente información:
1.- Mostrar que fases están presentes a diferentes composiciones y temperaturas bajo condiciones de enfriamiento lento ( equilibrio).
2.- Obtener la solubilidad , en el estado sólido y en equilibrio, de un elemento ( o compuesto en otro).
3.- Determinar la temperatura a la cual una aleación enfriada bajo condiciones de equilibrio comienza a solidificar y el rango de temperatura en el que se presenta la solidificación.
4.- Conocer a temperatura de las fases en la cual comienza a fundir.
2.- Diagrama de fases de fases binario isomorfo
Considérese ahora una mezcla o una aleación de dos metales en vez de sustancias puras. Una mezcla dos metales se llama aleación binaria y constituye un sistema de dos componentes, puesto que cada elemento metálico de la aleación se considera un componente separado. Por ejemplo el acero al carbono que contienen principalmente hierro y carburo de hierro se consideran sistemas de dos componentes.
En algunos sistemas binarios metálicos, los dos elementos son solubles entre sí, tanto en estado sólido como en estado líquido. En estos sistemas sólo existe un único tipo de estructura cristalina para las composiciones de los componentes, y por tanto se llaman sistemas isomorfos. En relación con los dos elementos que se disuelven completamente entre sí, normalmente satisfacen una o más de las reglas Hume- Rothery:
1.-Menos de, aproximadamente 15% de diferencia en el radio atómico.
2.-la misma estructura cristalina.
3.- Electronegativos similares (habilidad del átomo para atraer un electrón)
4.- la misma valencia.
Un ejemplo importante de un sistema de aleación binaria isomorfa, es el sistema Cu-Ní . En la figura 2 el área sobre la línea superior del diagrama, llamada líquidus , corresponde a la región de estabilidad de la fase líquida, y el área por debajo de la línea inferior, o sólidos, representa la región de estabilidad para la fase sólida. Entre ambas líneas se presenta una región de dos fases que coexisten la fase líquida y la fase sólida.
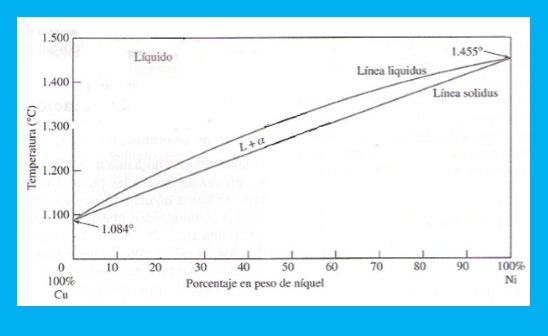
Figura 2: Diagrama Cu-Ni
Fuente: Propia
2.1.- Análisis del diagrama de fases
a.-Identificación de las fases
Se tiene el siguiente diagrama,( figura 3) de fases para el sistema plomo- estaño ( Pb-Sn).
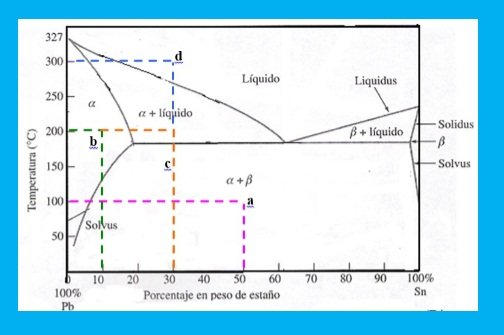
Figura 3: Diagrama (Pb-Sn)
Fuente: Propia
Por ejemplo:
*A 50 % Sn y 1000 C ( punto a) , indica que se encuentra en dos fases sólidas : α una solución sólida rica en plomo con algo de estaño disuelto y β una solución rica en estaño con algo de plomo disuelto. ( línea color fucsia).
*A 200 0 C una aleación de 10 % estaño y 90 % plomo ( punto b), se encuentra en una región que está enteramente en la fase α. ( línea color verde).
*A la misma temperatura, pero para 30% de estaño y 70% plomo ( punto c), indica una mezcla de dos fases α. Y líquido ( línea color naranja).
*Si ésta aleación fuese calentada a la temperatura de 3000 C ( punto d), se volvería líquida. (línea de color azul)
b.-Composición Química de las fases.
b.1.- Región Monofásica: La determinación de la composición química de una monofase es automática. “Tiene la misma composición que la aleación”.
Ej. Utilizando el diagrama de fases plomo-estaño (Figura 4) a 225 grados cenígrados una aleación de 60 Sn-40Pb ( punto e), ( línea color verde) se observa una fase líquida cuya composición es 60-40. Esto también es válido cuando la posición en el diagrama de fases implica una solución sólida monofásica.
b.2.- Región Bifásica: La composición química de las dos fases se localiza en los extremos de una “Isoterma” que cruce la región bifásica y luego descender mediante líneas verticales hasta el eje horizontal de las composiciones.
Por ejemplo: Del diagrama de fases plomo- estaño (figura 4).
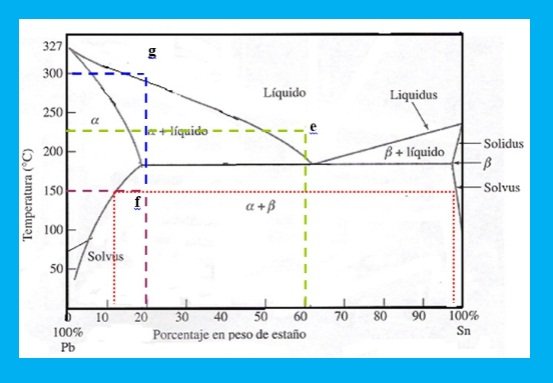
Figura 4:Diagrama Pb-Sn
Fuente: Propia
Una aleación 20Sn-80 Pb a 1500 gardos centígrados (punto f ),(línea de color violeta) tiene una composición química aproximada α = 12% Sn y β= 97% Sn. (Según lo indica la isoterma punteada de color rojo) Se selecciona una escala a trabajar.
c.- Cuantificación de las fases
c.1.- Regiones monofásicas: Utilizando el diagrama de fases Pb- Sn ( del diagrama 4) en 225 gramos de una aleación 20 Sn – 80Pb a 300 grados centígrados ( punto g), sólo hay presentes 225 gramos de líquido. Es válido decir que toda la aleación es 100% líquida.
c.2.-Regiones Bifásicas: Los porcentajes en peso de las fases en las regiones bifásicas de un diagrama de fases en equilibrio se calculan mediante la “regla de la palanca”.
Por ejemplo:
Una aleación cobre- níquel (figura5) contiene 47% en peso de Cu y el 53% en peso de Ni y está a 1300 grados centígrados.
a.- Cual es la composición del cobre a dicha temperatura?
b.- Que porcentaje en peso de aleación es líquida y que porcentaje es sólida?
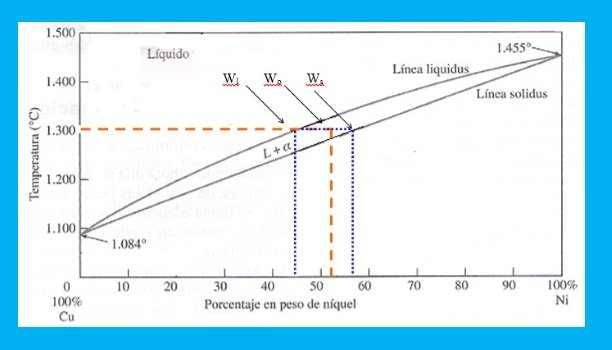
Figura 5: Diagrama Cu-Ni
Fuente: Propia
Solución:
a.- la intersección de la isoterma a 1300 grados centígrados con la línea de líquido da un aproximado de 55 % en peso de Cu en la fase líquida, y la intersección con el líquido ofrece un aprox. de 42% en peso de cobre en la fase sólida.
b.- usando la regla de la palanca para la isoterma a 1300 grados centígrados
W0 =53% Ni Wl =45% Ni Ws =58% Ni
Nota: Se toma el resultado de una escala, ya sea Níquel ó la del Cu.
Entonces:

Conclusión
Los diagramas de fases son específicos para cada aleación, y a través de estos se puede conocer el comportamiento del material con respecto a la temperatura y su composición.
Para el análisis de estos diagramas de fases se debe tener en cuenta los siguientes aspectos:
La región en que el punto se encuentra,
La composición química y
La cantidad de fases.
Tomando en consideración si el punto a estudiar esta una región monofásica o en una región bifásica.

Bibliografía consultada
Willaim Smith, Ciencia e Ingeniería de los materiales.
James Shackeford. Materiales e Ingeniería de los materiales.
Flin y Trojan. Materiales Tecnológicos.

Has recivido un voto por @cultivandojuntos, Un voto hecho por un bot de construccion experimental en la comunidad de la etiqueta español
Saludos desde Santa Ana de Coro, Capital del Estado Falcón. Interesante el post, los diagramas de fase siempre los he trabajado como Ing. de Procesos. Pero primera vez que lo veo con aplicaciones metalúrgicas muy didáctico.
Por cierto en el conciso "b" de la solución, colocaste 13 000 grados Celsius. Se te paso un cero jejeje ya estaríamos en otra fase.
SALUDOS DESDE EL CRP, CARDÓN PARAGUANÁ
Hola!! GRACIAS POR LA ACOTACIÓN. YA LA CORREJÍ! QUE BIÉN! NO ESTOY SOLA EN ESTE PEDACITO DEL MUNDO. QUIÉN ESTÁ DETRÁS DE ESE HERMOSO LOGO?
UN SELENITA JEJEJEJEJEJE
Y no te creas hay más de un Falconiano por estos mundo de Dios. Con la caída del valor del criptosteemit ha bajado mucha su actividad.
Te invito a unirte al servidor en Discord de #STEM-Espanol, donde puedes participar y recibir más feedback.
Saludos @betzy, otro falconiano te saluda por acá. Ciertamente los diagramas de fases tienen muchas aplicaciones, no solo en metalurgía, en química son muy importantes en operaciones como la recuperación de compuestos por cristalización. Te invito a revisar los criterios y normas para la curación por STEM-Espanol, también a participar en el servidor de Discord de #STEM-Espanol como te señalo @eniolw
Saludos @betzy comprendo perfectamente que cierto tipo de temas no se puede cambiar su contenido, es decir realizar una recopilación de lo más importante, resúmenes, análisis, etc. Pero en este caso se encuentra contenido similar en la web lo que viola las reglas de steemSTEM y puedes incurrir al plagio. Te recomiendo leer las normas en el canal #post-informativos del nuestro servidor en discord y analizar los criterios establecidos.
De igual forma es recomendable para este tipo de contenido realizar un resumen de lo más relevante desde tu propio punto de vista!. Se que puedes porque como investigador en el área de los semiconductores conozco mucho del tema y se que puede! Saludos
Thank you so much for voting for us! Hopefully you will get a chance to try out Partiko soon!
Posted using Partiko Messaging