Estudio de la calidad del aire del laboratorio de microbiología ambiental y sus exteriores a partir de indicadores microbiológicos
Es importante el estudio de los microorganismos que se dispersan el aire ya que dan una idea del grado de contaminación y las condiciones en la que se encuentran dichos ambientes, por otra parte se puede lograr determinar el grado de incidencia que tiene el aire en la salud de las personas que conviven en los alrededores (Romero y Col, 2016). El aire no es un medio idóneo para el desarrollo de microorganismos, sin embargo es un medio óptimo para la dispersión de bioaerosoles.
El aire es un medio de dispersión de gran cantidad de microorganismos patógenos como hongos por sus esporas y bacterias, la cantidad y diversidad de dichos organismos demuestran la calidad del aire respirable en cierta localidad siendo este uno de los factores claves en las condiciones optimas para ocupar un lugar (Romero y Col, 2016), una alta concentración de organismos patógenos en el aire de una localidad puede generar una idea de una “mala salud” de un recinto, la OMS en 1982 definió esto como el síndrome del edificio enfermo el cual se define como el conjunto de enfermedades presentadas producto de la contaminación del aire en estos espacios cerrados.
Es de gran interés analizar la calidad del aire en laboratorios de microbiología, ya que estos espacios generalmente cuentan con un alto índice de contaminación, siendo esto un riesgo para las personas que habitan gran cantidad de tiempo en estos lugares, así como también podría afectar diversos proyectos a llevar (Romero y Col, 2016). Para el estudio de la calidad de aire existen los métodos pasivos en el cual hay una deposición natural de bioaerosoles sobre un medio y métodos activos en los cuales se forza el paso del aire en un flujo constante sobre un medio que capte los microorganismos bioaersoles (Zamora A y Col 2018). Estos bioaerosoles usan el aire como medio de dispersión y transporte siendo capaz de llegar a afectar a personas que respirar más de 14m3 de aire al día. (Pérez M y Col, 2015)
En lugares cerrados donde hay gran porcentaje de humedad, temperatura optima y gran cantidad de polvo predomina la proliferación de hongos, así como la dispersión de sus esporas, según Gesellshaft M, 2018, en cada metro cúbico de aire se dispersan entre 1.000 y 10.000 esporas de hongos.
En investigaciones realizadas en la calidad de aire en los laboratorios de microbiología ambiental de la Universidad de Murcia, se estima que las bacterias Gram positivas predominan en edificios cerrados sobre las bacterias Gram negativas, debido a que son más resistentes y logran perdurar en el tiempo (Romero y Col, 2016).

Metodología Experimental
1-Medición de Parámetros Ambientales.
-Se tomaron medidas de humedad relativa y temperatura cada 15minutos durante todo el muestreo con el higrómetro.
-Se determinó la velocidad y dirección de la corriente de aire con un anemómetro.
2- Muestreo Pasivo
Para la toma de muestras se utilizaron 24 placas de Petri, distribuidas en 12 placas de AN y 12 de PDA.
- Se ubicaron 3 placas de cada medio (AN y PDA) en el mesón junto a la ventana, 3 en el mesón intermedio y 3 en el mesón cercano a la puerta de entrada del laboratorio. Las 3 placas restantes se colocaron en el área exterior de la ventana del laboratorio.
- Se destaparon las placas y fueron expuestas al aire por un periodo de una hora. Una vez cumplido este tiempo, se volvieron a cubrir.
- Se Incubaron a temperatura de 37ºC por 24-48 horas las placas de AN y las placas de
PDA se incurvaron durante 7dias a temperatura ambiente.
3- Muestreo Activo
Se utilizó para este muestreo el equipo Hi Air Sampler (HiMedia®) con tiras de medio PDA y AN.
- Se tomaron las tiras conteniendo AN y PDA, y se colocaron en el
- equipo.
- Se encendió el equipo y se ajusto el tiempo a 3 minutos.
- Se realizó el recorrido moviéndose por toda el área del laboratorio.
- Se retiro la tira, y posteriormente se incubaron las de AN a 37ºC durante 24-48h y las de Agar malta a temperatura ambiente por 7 días.
Estos procedimientos de muestreo se realizaron en la zona exterior al laboratorio.
Finalmente se realizaron microcultivos e improntas para la identificación de la comunidad fúngica asociada a las muestras de aire.

Resultados



Discusión
La presencia de microorganismos en un laboratorio de microbiología puede suponer un riesgo para los habitantes del lugar así como para los ensayos o estudios realizados (Perez M y Col, 2015). En un ambiente interno, en este caso el laboratorio de microbiología ambiental de la UCV es es un medio idóneo para el hábitat de microorganismo, los cuales logran prolifera a través de ventanas abiertas (entrada de aire), el polvo, entre otras las actividades antropocéntricas como el caminar, hablar, peinarse entre otras dispersando las partículas o bioaerosoles suspendidos en el aire.
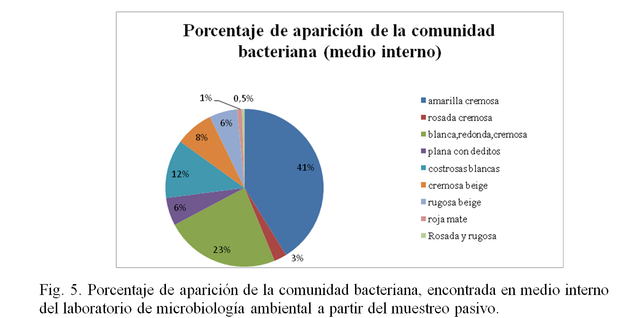
La calidad del aire se puede determinar a través de la cantidad de microorganismos presentes en una localidad, la Tabla I se presentan la cantidad de UFC de microorganismos Fúngicos y bacterianos encontrados en el aire interno del laboratorio de microbiología ambiental a través del método de muestreo pasivo, se puede observar que las cantidades de colonias formadas por placas superan las 30 colonias en la mayoría de los casos. El método de muestreo pasivo o de sedimentación por gravedad, fue uno de los primeros métodos utilizados para determinar la calidad del aire debido que se considera económico, fácil y rápido. Este método corre con la ventaja de que se logran observar en las placas de medio de cultivo los microorganismos viables encontrados en suspensión, depositados debido a la gravedad y al flujo del aire, lo que permitió la posterior identificación de ciertos microorganismos, En las figuras (Fig.1- Fig.5) se presenta la diversidad de la comunidad fúngica y bacteriana encontrada en el medio interno a través de dicho método, sin embargo no se logra determinar cuantitativamente un titulo exacto debido a que no se sabe con exactitud el volumen de aire muestreado (M. C. de la Rosa y Col,2002).
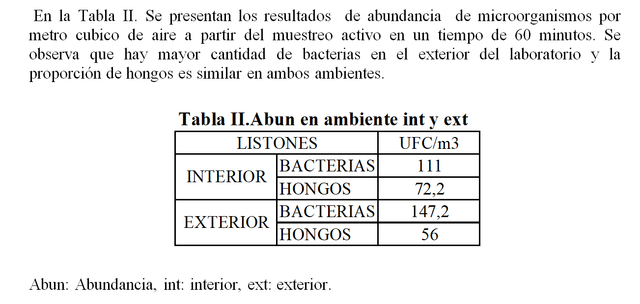
En el caso del muestreo activo es de los métodos para determinar calidad de aire más usado actualmente debido a que se logra determinar la abundancia de microorganismos en una localidad (Perez M y Col, 2015). El equipo utilizado fue el Hi Air Sampler este cuenta con una velocidad de rotación de 4000 RPM y tiene la capacidad de muestrear un total de 280 litros por minuto (A Zamora y Col,2018) este método es efectivo ya que obliga el paso del flujo de aire cargado de microorganismos en suspensión los cuales por inercia se adhieren a los medios de cultivos y así se logra abarcar una amplia extensión en el recinto . en la Tabla II se presentan los resultados de abundancia obtenidos a partir de este muestreo, nótese que se obtiene más abundancia bacteriana que fúngica en el interior y en el exterior a pesar de que los hongos al encontrarse suspendidos en el aire como esporas tienden a ser más resistentes debido a que presentan metabolismo bajo y no requieren de condiciones nutricionales ni agua para su supervivencia, además algunas esporas poseen estructuras gruesas que las protegen de la desecación a diferencia de las bacterias que a pesar de que son ubicuas su supervivencia es variable y depende en gran parte del grosor de la capa de péptidoglicanos, es por esto que en general en el aire se logran encontrar mayormente bacterias Gram positivas(M.C. de la Rosa y Col,2002). Comparando los resultados obtenidos (Tabla II) con los datos establecidos por la OMS (Tabla III) en términos de contaminación bacteriana el interior y exterior del laboratorio se encuentra dentro de los rangos intermedios a diferencias de la contaminación fúngica que se reporta como baja, determinando así que el laboratorio de microbiología ambiental no es un edificio enfermo del todo, cabe destacar que antes del desarrollo de cada práctica se realiza limpieza con cloro y alcohol pudiendo disminuir la concentración de microorganismos.
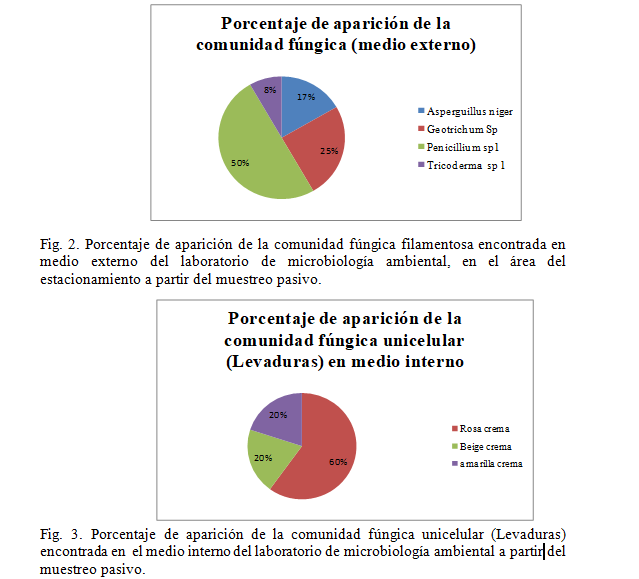
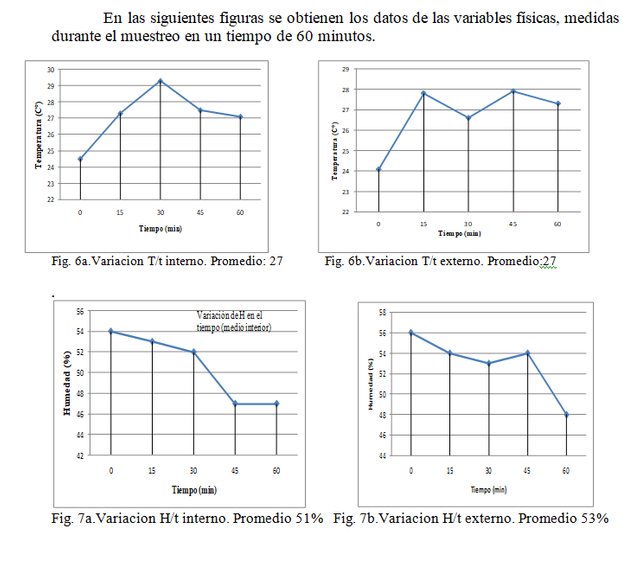
En términos de diversidad fúngica filamentosa se infiere según el método pasivo que es mayor en el medio interno del laboratorio en comparación al medio externo (estacionamiento), obteniéndose según la Fig.1. 8 morfotipos y en la Fig.2. 4 morfotipos, es decir que se redujo a la mitad, esto se puede interpretar debido a que internamente las condiciones de exposición de luz es menor lo que previene la desecación. En términos de humedad relativa no existen grandes diferencias entre el ambiente interno (Fig. 7a) y el ambiente externo (Fig. 7b), siendo este factor ambiental más importante en la proliferación de microorganismos ya que es la fracción de agua contenida en el aire, según M. C. de la Rosa y Col el limite menor de humedad relativa para el crecimiento de hongos es del 65%, en el caso de los ambientes muestreados el promedio durante una hora de muestreo fue de 51% para el medio interno y de 53 % para el medio externo. La temperatura también es un factor esencial en la proliferación de microorganismos, ya que va de la mano a la humedad relativa y el efecto que tienen estos parámetros en la desecación y el agua disponible para hongos y bacterias (M.C. de la Rosa y Col, 2002), estudiando este parámetro, no hubo variación en el promedio obtenido (27 C°) tanto internamente como externamente, siendo esta una temperatura optima para el crecimiento de microorganismos. La velocidad y el flujo de aire determinan la dispersión de los bioaerosoles (M.C. de la Rosa y Col,2000), internamente no se evidenció por parte del anemómetro velocidad en el aire, manteniéndose 0 m/s2 durante todo el muestreo, a diferencia del medio externo el cual se reporta un promedio de 0,764 m/s2 En cuanto a la diversidad fúngica unicelular o levaduras se obtuvo una cantidad similar de morfotipos en ambas localidades.
Los géneros obtenidos a través del método pasivo se presentan en la Fig.1 (medio interno) y Fig.2. (Medio externo). En el medio interno prolifera la aparición de los generos Trichoderma sp, Conidiobulos sp, Penicillium sp y Aspergillus sp, siendo los dos últimos mencionados los más abundantes encontrados en muestras de aire según lo reportado por (Perez M y Col, 2015) y (Perez M y Col, 2015) y en muestras de suelo (Samaniego J y Chew Y, 2006) a diferencia de Trichoderma sp, Conidiobolus sp y Geotrichum sp que son géneros reportados generalmente en muestras de suelo, sin embargo por el flujo de aire, esporas encontradas en partículas de suelos podrían conseguirse en los al rededores de la Facultad de Ciencias y estas podrían dispersarse.
En un edificio donde proliferen una gran abundancia bacteriana y fungica los habitantes pueden sufrir de ciertas patologías respiratorias producidas por los microorganismos(Perez M y Col, 2015). El aire por naturaleza esta cargado de diversas partículas que costantemente entran por las vías respiratorias sin embargo el sistema inmune las combate sin embargo existen casos de inmunosupresión o alergías crónicas donde pueden avanzar enfermedades Entre las enfermedades más comunes relacionadas a la exposición a una alta carga microbiana se encuentran las Micotoxicosis pulmonaria, Neumonitis hipersensible y las alergias relacionadas al síndrome del edificio enfermo (Perez M y Col, 2015). Según Khan y Karuppayil 2012, la sinusitis está relacionada a ambientes contaminados por hongos y filtraciones de agua que incrementan la humedad, al género Aspergillus sp se le atribuye la enfermedad de la Aspergilos Pulmonar Cavitaria Crónica (APCC), el aspergiloma, la rinosinusitis, el aspergilomasinusal, queratitis fúngica, al Conidobolus sp se le atribuye la conidiobolumicosis como afección rinofacial, que afecta tejidos blancos de los senos paranasales así como la faringe (Moncada D, 2016), para el caso de Geotrichum sp puede llegar a ser un hongo patógeno oportunistas en pacientes inmunosuprimidos.
Las bacterias que se encuentran suspendidas en el aire pueden ser protagonistas en diversas enfermedades respiratorias, estas generalmente son Gram positivas y oportunistas en caso de personas inmunosuprimidas o infectadas viralmente, las enfermedades más comunes son la amigdalitis, bronquitis, faringitis y las relacionadas con inflamación del tracto respiratorio.
La profilaxis para evitar estas enfermedades es recurrir a programas de limpieza y desinfección manteniendo areas libres de polvos, evitar filtraciones de agua en paredes y techos para mantener la humedad por debajo del 60% (Perez M y Col, 2015).

Referencias Bibliográficas
• De la Rosa MC, Mosso MA, Ullán C. (2002) El aire: hábitat y medio de transmisión. Observatorio Medio Ambiental Universidad Complutense. Madrid, España 2002; 5:375-402
• Khan H, Karuppayil M. (2012)Fungal pollution of indoor environments and its management. Saudi Journal of Biological Sciences.
• Moncada D, Montes M, Molina V, Velásquez J, Gómez C, (2016) Infección orofacial por Conidiobolus coronatus, Biomédica Revista del Instituto Nacional de Salud vol.36, Colombia.
• M Pérez , Martínez D , Hernández P (2015) Contaminación microbiológica del aire al interior y el síndrome del edificio enfermo, Rev Biociencias, Vol. 10, Número 2 , 37 - 50 , Universidad Libre Seccional Barranquilla. Colombia.
• Romero C, Castañeda D, Acosta G, (2016) Determinación de la calidad bacteriológica del aire en un laboratorio de microbiología en la Universidad Distrital Francisco José de Caldas en Bogotá, Colombia.
• Samaniego J y Chew Y (2007) Diversidad de géneros de hongos del suelo en tres campos con diferente condición agrícola en La Laguna, México, Rev Mexicana de biodiversidad.
• Zamora A, Malaver N, Pino M, (2018) Guía de Laboratorio de Microbiología Ambiental, Facultad de Ciencias UCV, Caracas- Venezuela.
Todas las tablas e imágenes son de mi autoría.

¡Felicidades! Esta publicación obtuvo upvote y fue compartido por @la-colmena, un proyecto de Curación Manual para la comunidad hispana de Steemit que cuenta con el respaldo de @curie.
Si te gusta el trabajo que hacemos, te invitamos a darle tu voto a este comentario y a votar como testigo por Curie.
Si quieres saber más sobre nuestro proyecto, acompáñanos en Discord: La Colmena.
This post was shared in the #spanish-curation channel in the Curation Collective Discord community for curators, and upvoted and resteemed by the @c-squared community account after manual review.
@c-squared runs a community witness. Please consider using one of your witness votes on us here