Influencia de algunas alteraciones sobre la generación de potenciales de acción y evaluación de la discriminación mecanosensitiva, olfativa y gustativa
Los potenciales de acción son el mecanismo eléctrico que emplean las células excitables para transmitir señales en toda la red nerviosa. Los sistemas sensitivos, se valen de estas señales eléctricas para codificar información ambiental y llevarla hasta el sistema nervioso central para ser percibidas. Existen muchos factores, en cuando a condiciones celulares que determinan la generación de los potenciales de acción, y por tanto el funcionamiento de toda la cadena nerviosa que se sostiene de ellos.En función de esto, en el presente estudio se describe el proceso de determinación del efecto que tienen algunas alteraciones, omo las concentraciones y permeabilidad diferencial de Na+, K+ y Cl-
la presencia de tetrodoxina (TTX), tetraetilamonio (TEA) y pronasa, y los tipos y duración de los estímulos, sobre el potencial de acción empleando un simulador que sigue la ecuación de Hodgkin-Huxley. También se describe el proceso de evaluación de la capacidad de discriminación mecanosensitiva en diferentes partes del cuerpo y gustativa en la punta y parte posterior de la lengua en humanos, así como también la discriminación olfativa en ratones (Mus musculus) usando sardina, agua y alcohol como estímulos olfativos al final de un laberinto. Finalmente, se discutieron algunos aspectos referentes al procesamiento de la información visual.
1. INTRODUCCIÓN
Todos los procesos fisiológicos en los que se encuentra involucrado el sistema nervioso, dependen directa o indirectamente de la transmisión de señales eléctricas entre células. Dichas señales son consecuencia de la difusión de potenciales de acción, producidos por algún estímulo que es recibido y transformado en las células sensitivas (Silverthorn et al., 2008). En concreto, los potenciales de acción son inversiones momentáneas del potencial de membrana desde alrededor de -65 mV hasta los 40 mV, es decir un cambio de aproximadamente 100 mV. Estos duran alrededor de 1 ms y es seguido por el restablecimiento del potencial de membrana original o potencial de reposo (Hill et al., 2006). Las células nerviosas excitables, en la mayoría de los casos poseen una concentración de aniones interna mayor en relación con el medio extracelular, de manera que se genera una diferencia de voltaje o de potencial eléctrico. En una célula en reposo, dicho potencial se ve determinado por dos propiedades eléctricas pasivas: resistencia y capacitancia. La primera surge ya que los iones deben pasar a través de canales iónicos restrictivos en la membrana, porque la bicapa lipídica es impermeable a ellos. Similarmente, la capacitancia se da a su vez por las propiedades aislantes de la bicapa lipídica que impiden la libre difusión de los iones (Hill et al., 2006). La combinación de ambas propiedades, generan el estado de referencia del voltaje o potencial de reposo que es invertido en las células excitables cuando se genera la señal eléctrica.
Por su parte, los potenciales de acción se originan debido a cambios en la permeabilidad de la membrana a los iones sodio (Na+), potasio (K+) y cloro (Cl-). En condiciones de reposo las concentraciones de Na+ y Cl- internas son bajas con respecto al exterior, mientras que el K+ se encuentra en mayor concentración en el interior (Silverthorn et al., 2008). Cuando se genera el potencial de acción debido a algún estímulo, la membrana se hace más permeable al Na+ y el aumento de las concentraciones internas del catión por encima del umbral eléctrico desencadena la apertura de los canales de Na+ dependientes de voltaje. Dicha apertura potencia la entrada de Na+ al interior celular (en función del gradiente electroquímico), ocasionando que el potencial de membrana se haga muy positivo al pasar de -65 mV a 40 mV, escenario conocido como despolarización. En este punto, la permeabilidad de la membrana al Na+ disminuye abruptamente con la inactivación de los canales de Na+ dependientes de voltaje. Seguidamente se abren los canales de K+ también dependientes de voltaje permitiendo la salida de K+ de la célula (siguiendo su gradiente electroquímico). Por consiguiente arrastrando el potencial de membrana hacia valores negativos cercanos al potencial en reposo (repolarización) y luego por debajo de este (hiperpolarización). Posteriormente, se inactivan los canales de K+ dependientes de voltaje, y la célula vuelve al potencial en reposo con ayuda de bombas iónicas (como la bomba sodio-potasio) que restituyen las concentraciones iónicas internas (Lodish et al., 2016).
Las células sensitivas o receptores, células especializadas en la recepción de estímulos ambientales particulares, convierten la energía asociada a los fenómenos químicos, térmicos, mecánicos y electromagnéticos que inciden sobre ellas, en señales eléctricas que viajan al sistema nervioso para ser percibidas y/o dar respuesta a ellas (Campbell et al. 2014), es decir, se valen de la generación y transmisión de potenciales de acción. El proceso sensitivo se puede resumir en al menos cuatro etapas, de las cuales la primera es la absorción del estímulo, que luego de ser cuidadosamente filtrado causa un cambio en el potencial de membrana de la célula sensitiva o receptor, originando lo que se conoce como potencial receptor, que corresponde a la etapa de transducción. Luego de esto, la señal es amplificada y/o adaptada para finalmente dispersarse hasta el sistema nervioso periférico y luego central, pudiendo pasar antes por un proceso de integración en el que los potenciales se suman. El último paso del proceso sensitivo es la percepción, que ocurre cuando los potenciales de acción provenientes de una neurona sensitiva llegan al cerebro y se les asigna un significado o percepción (Campbell et al., 2014; Hill et al., 2006). Si bien el principio de producción de los estímulos sensoriales es casi siempre el mismo, la evolución ha dotado a los animales con sistemas sensoriales complejos y muy especializados en distintos tipos de estímulos. Así, existen los mecanoreceptores que detectan deformaciones causadas por energía mecánica, los quimiorreceptores que detectan sustancias químicas, los termoreceptores que reaccionan a cambios en la temperatura y los receptores electromagnéticos que detectan formas de energía electromagnética como la luz y la electricidad (Campbell et al., 2014).
Debido a que los potenciales de acción son un fenómeno necesario para la comunicación nerviosa y los sistemas sensitivos, y que además su generación depende de factores tan sutiles como concentraciones iónicas en el orden de los mM, resulta prudente su estudio, sobretodo bajo condiciones diferentes a las usuales. En función de esto, el presente estudio busco evaluar los cambios o variaciones que se dan en la generación de los potenciales de acción debido a alteraciones específicas de las condiciones celulares normales, mediante simulaciones que siguen la ecuación de Hodgkin-Huxley. De este modo, se evaluaron los efectos de las concentraciones iónicas de Na+, K+ y Cl- y la permeabilidad diferencial de la membrana a estos. De igual forma, se estudió el efecto de las drogas tetrodoxina (TTX), tetraetilamonio (TEA) y Pronasa (PRO) y de los tipos y duración de los estímulos, indagando además en los conceptos de periodo refractario relativo y absoluto. Por otra parte, se estudió la capacidad de discriminación o sensibilidad de los sistemas mecanosensitivo, olfativo y gustativo, respectivamente a dos estímulos físicamente cercanos en la piel en distintas partes del cuerpo, a olores de agua, sardina y alcohol, y a diferentes concentraciones de NaCl en la región anterior y posterior de la lengua. Finalmente, se discutió sobre el procesamiento de la información visual y los estereogramas.
2. MATERIALES Y MÉTODOS
2.1. Cambios en la generación de potenciales de acción debido a alteraciones de las condiciones celulares normales en axón de calamar
Para la generación de los potenciales de acción se empleó el software de libre acceso HHsim Hudgkin-Huxley Simulator versión 3.1 (Touretsky et al., 2008), que simula las diferentes condiciones normales y de estimulación para una sección de la membrana excitable del axón gigante de neurona de calamar, siguiendo el modelo de Hodgkin-Huxley. Todos los potenciales de acción, a menos que se especifique lo contrario, fueron generados a 6,3 °C y a partir de estímulos eléctricos de 10 nA de intensidad y 1 ms de duración. En caso de que fuesen inhibitorios la intensidad era de -10 nA y la duración de 2 ms. Los parámetros fueron manipulados en el simulador y los gráficos tratados empleando el software Microsoft Office PowerPoint 2010, de acuerdo a lo establecido en la guía de prácticas de laboratorio de fisiología animal (Andara & Sánchez, 2016).
2.1.1. Efecto de las concentraciones de iones intra y extracelulares
Se generó un potencial de acción de referencia, usando las concentraciones iónicas normales en el axón de calamar (Tabla I). Luego se llevó el valor de concentración externa de Na+ hasta 50,00 mM, evaluando el efecto en la generación del potencial de acción. Después de restituir las condiciones normales, se llevó la concentración interna de K+ hasta 50,00 mM. Posteriormente se llevó la concentración interna de Cl- hasta 100,00 mM, evaluando en estas condiciones y finalmente se cambió el valor de concentración interna de Na+ a 100,00 mM para evaluar ambas alteraciones juntas.
Tabla I. Concentraciones intra y extracelulares de los iones principales en el axón gigante de calamar (Touretsky et al., 2008; Hill et al., 2006).
| Ión | Concentración intracelular (mM) | Concentración extracelular (mM) |
|---|---|---|
| Na+ | 50 | 440 |
| K+ | 400 | 20 |
| Cl- | 52 | 560 |
2.1.2 Efecto de la permeabilidad diferencial de la membrana celular a distintos iones
Para determinar el efecto de la permeabilidad de la membrana a diferentes iones se inactivaron los canales de Na+ dependientes de voltaje, observando los cambios generados en el potencial de acción. De manera independiente, se inactivaron los canales pasivos de Na+, K+ y Cl- y se observó su influencia.
2.1.3. Efecto del tipo de estímulo y su duración y del periodo refractario absoluto y relativo
Se evaluó el efecto de un estímulo eléctrico de tipo inhibitorio sobre el potencial de acción y luego se aumentó la intensidad hasta -40 nA para observar que ocurría en estas condiciones. Posteriormente, se aplicaron estímulos inhibitorios y excitatorios aumentando el tiempo de duración de estos hasta 6 ms. Se aplicó también un estímulo de tipo excitatorio de manera consecutiva y rápida durante cierto tiempo, para detallar el efecto en el potencial de acción relacionado con el periodo refractario absoluto y relativo.
2.1.4. Evaluación del efecto de algunas drogas
Se aplicó tetrodoxina (TTX) al 50 y 90% de inhibición, tetraetilamonio (TEA) al 80% y 30%, y pronasa (PRO) para evaluar su efecto en la generación de los potenciales de acción.
2.2. Evaluación de la discriminación sensorial
Siguiendo de igual forma el protocolo de la guía antes mencionada (Andara & Sánchez, 2016), se realizaron los experimentos para evaluar la discriminación mecanosensitiva, olfativa y gustativa. Se procuró que los sujetos de ensayo no hubiesen ingerido alimentos 2 horas antes de la realización de las pruebas, además de no haber realizado actividades físicas prolongadas. El laboratorio se mantuvo exento de olores fuertes (perfumes, fragancias, entre otros). Los resultados obtenidos fueron analizados estadísticamente empleando el software de libre acceso PAST versión 3.14.
2.2.1. Estimulación mecánica de los receptores de la piel en diferentes regiones del cuerpo
Empleando un Vernier se estimuló la piel de un total de seis individuos (humanos) de entre 20 y 24 años de edad, tres del género masculino y tres del femenino. El estímulo fue aplicado usando las dos puntas del Vernier sobre la piel a una distancia inicial de partida de 2 mm , la cual se fue ampliando en un factor de 2 mm en 2 mm , hasta que el individuo experimental que estaba con los ojos vendados percibiera el estímulo de las puntas del Vernier como dos puntos o estímulos separados. Las regiones del cuerpo a estimular fueron la mejilla, el antebrazo, la pantorrilla, la parte baja de la espalda, la palma de la mano, la punta de los dedos y el cuello. Además, el experimento se hizo de manera tal que los individuos no pudiesen predecir la zona que se fuera a estimular ni la distancia relativa entre las dos puntas del Vernier. Los resultados fueron comparados empleando la prueba no paramétrica de Kruskal-Wallis para determinar si existen diferencias en cuanto a la capacidad de discriminación entre las distintas partes estimuladas. Finalmente, se empleó la prueba de Mann-Whitney para evaluar diferencias en cuanto a la discriminación en función del género, con los resultados de dedos y antebrazos.
2.2.2. Tiempo de respuesta de Mus musculus ante una estimulación olfativa al final de un laberinto
Un total de seis ratones machos juveniles (Mus musculus) fueron colocados uno a la vez al inicio de un laberinto al final del cual se encontraba un estímulo olfativo. Dichos estímulos fueron agua, alcohol y sardina. Se documentó el tiempo que tardó cada ratón en llegar al final del laberinto, y el número de errores que cometía antes de llegar, entendiéndose por error el hecho de que el animal entrara a una rama del laberinto en la que no se encontraba el estímulo. Siendo un total de seis réplicas por estímulo, se usó la prueba de Kruskal-Wallis para determinar la existencia de diferencias entre la respuesta ante los diferentes estímulos, tanto en el tiempo, como en la cantidad de errores.
2.2.3. Intensidad del estímulo gustativo percibido por el sujeto experimental bajo diferentes concentraciones de NaCl y en diferentes regiones de la lengua
Los sujetos experimentales fueron seis personas de entre 20 a 24 años de edad, tres del género masculino y tres del femenino. Se emplearon soluciones de NaCl al 0,005 , 0,1 , 0,3 y 0,5 M y se aplicaron una por una en la lengua de un individuo con los ojos vendados. Se procuró aplicar dos gotas de la solución en la punta de la lengua y en la parte posterior de ésta, y se pidió al sujeto experimental que dijera qué tan intenso era el sabor en una escala del 1 al 10, dejando dos minutos entre cada aplicación, y procurando que esta fuese aleatoria para impedir que el sujeto predijera la posible concentración de la solución. Para evaluar la existencia de diferencias entre cada concentración en las dos partes de la lengua y entre ellas para la solución 0,5 M, se usaron las pruebas de Kruskal-Wallis y Mann-Whitney respectivamente.
3. RESULTADOS Y DISCUSIÓN
3.1. Cambios en la generación de potenciales de acción debido a alteraciones de las condiciones celulares normales en axón de calamar
3.1.1. Efecto de las concentraciones de iones intra y extracelulares
Al cambiar la concentración externa de Na+ hasta 50 mM se observó que los potenciales de acción no se generaban, aun cuando los estímulos eléctricos lograban despolarizar la membrana por encima del umbral (Fig. 1a). De igual forma, se observó una disminución en el potencial reposo, siendo éste más negativo. Lo que ocurrió es que las concentraciones intra y extracelulares de Na+ se igualaron en 50 mM (tabla I) causando que dicho ión no se viera ya bajo la influencia del gradiente electroquímico y por tanto la entrada neta de Na+ fuese prácticamente nula. Siendo esto así, al aplicar el estímulo eléctrico se logra forzar la entrada de Na+ pero a pesar de que el potencial supera el umbral y se abren los canales de Na+ dependientes de voltaje, los iones no entraban a la célula porque ya no existía gradiente electroquímico significativo que los movilizara, y por tanto no se genera el potencial de acción (Hill et al., 2006; Hodgkin & Katz, 1949).
Por su parte, al bajar la concentración interna de K+ (tabla I) hasta 50 mM se generó un potencial de acción (Fig. 1b) luego del cual el potencial en reposo se estableció en -20 mM haciéndose más positivo. Al bajar la concentración interna de K+ hasta un valor mucho más
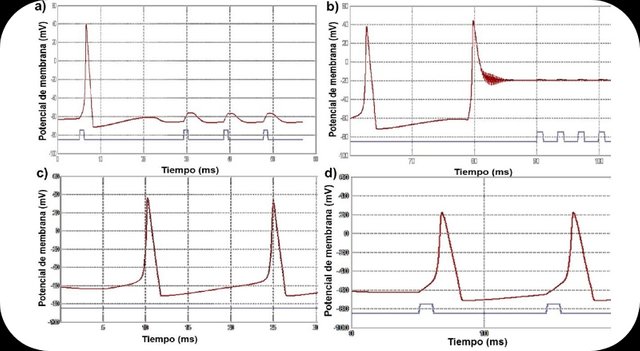
Figura 1. Gráficas de potenciales de membrana de axón de calamar vs tiempo bajo distintas condiciones. La linea roja representa el valor del potencial de membrana en mV y la azul representa el estímulo. a) Potencial de membrana de referencia, seguido de despolarizaciones leves generados a partir de estímulos cuando la concentración extracelular de Na+ disminuye a 50 mM. b) Potencial de referencia seguido de un potencial de membrana causado por la disminución de la concentración interna de K+ hasta 50 mM. No se generan potenciales de acción en estas condiciones. c) Potenciales de acción espontáneos y continuos generados con una concentración interna de Cl- de 100mM. d) Potenciales de acción solo alcanzan una despolarización hasta 20 mV cuando las concentraciones internas de Na+ y Cl- son 100 mM.
cercano al valor de concentración extracelular, la fuerza del gradiente electroquímico disminuye de tal forma que logra acumular cargas positivas dentro de la célula, debido a que ya el K+ no difunde tanto al exterior. Esta acumulación interna de K+ causa que inicialmente se genere un potencial de acción, y que luego el potencial de membrana halle un nuevo equilibrio el -20 mM (Adrian, 1956). Luego de que el potencial en reposo aumentara se observó que la aplicación de un estímulo eléctrico no generaba potencial de acción (Fig. 1b). Esto se debe a que al haber acumulación de iones positivos en el interior de la célula, el Na+ no logra entrar a la célula (pues encuentra oposición o repulsión eléctrica) en cantidades suficientes para causar la despolarización de la membrana y por consiguiente el potencial de acción (Hill et al., 2006). Cuando se aumentó la concentración interna de Cl- hasta 100 mM, se observó que los potenciales de acción se generaban de manera espontánea y continua, sin aplicar ningún estímulo (Fig. 1c). Esto se debe a que al haber más Cl- en el interior de la célula, se acumulan cargas negativas que favorecen el gradiente electroquímico de entrada del Na+, generando un aumento espontaneo en el potencial de membrana y por consiguiente generando potenciales de acción cíclicos o continuos (Keynes, 1963). Luego, al aumentar la concentración interna de Na+ hasta 100 mM (Fig. 1d) se restituyó el potencial de reposo de la membrana, pero los potenciales de acción generados a partir del estímulo alcanzaban una despolarización hasta un valor de solo 20 mV. Esto se explica ya que al aumentar la concentración interna de Na+ se disminuye la fuerza del gradiente electroquímico y por tanto no entra tanto Na+ a la célula, lo cual implica que no se generan potenciales espontáneamente, y que los potenciales no alcanzan a despolarizar la membrana tanto como en condiciones normales, pues la entrada del ion es ahora más limitada (Hill et al., 2006).
3.1.2. Efecto de la permeabilidad diferencial de la membrana celular a distintos iones
La inactivación de los canales de Na+ dependientes de voltaje evitó que en presencia de un estímulo que superaba el umbral, se generaran potenciales de acción (Fig. 2a). Esto se debe a que a pesar de que los estímulos lograban despolarizar la membrana lo suficiente para causar un potencial de acción, este nunca se generó ya que al estar inactivados lo canales de Na+ dependientes de voltaje, que son los encargados de generar la despolarización, no entraba ninguna cantidad significativa del ion al medio intracelular (Hill et al., 2006). En contraste, al desactivar los canales iónicos pasivos de Na+, K+ y Cl- se observó que el potencial de reposo de la membrana se hizo más negativo (Fig. 2b), y que si bien se generaban algunos potenciales de acción, estos eran seguidos de un periodo en el que no era posible generar otro potencial a partir del estímulo. Al inactivar los canales iónicos pasivos, la membrana es incapaz de mantener su potencial de reposo, pues si bien no hay movimiento pasivo de iones, si sigue habiendo movimiento activo debido a las bombas iónicas como la bomba sodio-potasio. Esta bomba, saca tres iones de Na+ por cada dos de K+ que introduce a la célula. De manera que cada vez que la bomba actúa el medio intracelular gana una carga negativa en comparación con el extracelular, lo cual explica la disminución del potencial en reposo. Por otra parte, si es posible generar un potencial de acción ya que los canales dependientes de voltaje aun funcionan, sin embargo, el retraso o dificultad en la generación radica en que ya que no hay transporte pasivo de iones, y la célula le es más difícil alcanzar el umbral de despolarización a pesar del estímulo (Lodish et al. 2016).
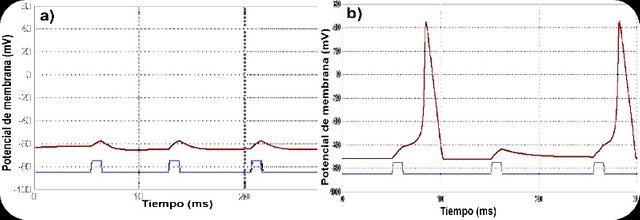
Figura 2. Gráficas de potenciales de membrana de axón de calamar vs tiempo bajo distintas condiciones. La linea roja representa el valor del potencial de membrana en mV y la azul representa el estímulo. a) Se observan las despolarizaciones ligeras causadas por el estímulos, que no logran generar un potencial de acción al estar inactivos los canales de Na+ dependientes de voltaje. b) Al estar inactivos los canales pasivos de Na+, K+ y Cl- se observa una disminución del potencial en reposo, y dificultad para la generación del potencial de acción por los estímulos
3.1.3. Efecto del tipo de estímulo y su duración y evaluación del periodo refractario
Un estímulo eléctrico con Amperaje negativo logra el efecto en la simulación de una sinapsis inhibitoria (Fig. 3a). En la gráfica, se observa que la membrana se hiperpolariza durante el estímulo y luego se genera el potencial de acción, pero retardado o más lento de lo que se generaría de haber sido un estímulo de tipo excitatorio. Al aumentar la intensidad del estímulo (Fig. 3b) la membrana se hiperpolariza aún más y le toma más tiempo generar el potencial de acción. Lo observado corresponde análogamente a lo que ocurre en el soma de las neuronas, en donde los distintos tipos de sinapsis llegan desde otros neuronas y se integran o suman para generar un potencial de acción en un tiempo particular o para no generarlo del todo (Lodish et al., 2016; Hill et al., 2006; Campbell et al., 2014). Posteriormente, al aumentar el tiempo de duración de un estímulo inhibitorio y uno excitatorio hasta 6 ms (Fig. 3c) el primero acelera un poco la recuperación del potencial de reposo luego de generar el potencial de acción, y el segundo hiperpolariza la membrana y retarda el potencial acción durante los 6 ms. Si bien ambos generan solo un potencial de acción, de haber sido más largo el tiempo del estímulo excitatorio este hubiese generado otro potencial de acción. Contrariamente, el estímulo inhibitorio tiende más bien a retardar la generación del potencial de acción, ya que hiperpolariza la membrana progresivamente durante toda la duración del estímulo. La hiperpolarización inhibitoria en los animales es mediada por neurotransmisores que aumentan la permeabilidad de la membrana al cloro, como lo hace el ácido gamma-aminobútirico (Randall et al., 1999).
En la Fig. 3d se pudo detallar que al aplicar diez estímulos excitatorios muy seguidos en escala temporal, solo se produjeron tres potenciales de acción definidos. Esto se debe al periodo refractario absoluto y al relativo. El primero se define como el tiempo durante el potencial de acción e inmediatamente después de este en el cual el umbral de voltaje es infinito y ninguna despolarización puede por lo tanto causar un potencial de acción. Por otra parte, el periodo refractario relativo es el periodo breve que sigue a un potencial de acción, en el cual el umbral de voltaje se eleva y no puede iniciarse ningún potencial de acción (Hill et al., 2006). En el gráfico (Fig. 3d) el periodo refractario absoluto corresponde al tiempo desde que se supera el umbral de voltaje y se desencadena el potencial de acción hasta que comienza la repolarización. Luego de esto le sigue el periodo refractario relativo, desde que empieza la repolarización, hasta que se recupera el potencial en reposo y se puede volver a generar un potencial de acción (como se observa también en el gráfico).
3.1.4. Evaluación del efecto de TTX, TEA y PRO en la generación de potenciales de acción
Cuando se aplicó la tetrodoxina (TTX) con 50% de inhibición (Fig. 4a) se observó dificultad para generar potenciales de acción, y los que se generaron eran de poca intensidad. Al aumentar la inhibición al 90% (Fig. 4b) los potenciales de acción dejaron de generarse por completo, a pesar de que el potencial causado por el estímulo superaba el umbral. Por su parte el tetraetilamonio (TEA) generó potenciales espontáneos y continuos. Al encontrarse al 80% de inhibición, causa retardos en el proceso de repolarización (Fig. 4c), que parecen revertirse al disminuir la inhibición al 30% (Fig. 4d). Lo opuesto se detalló al aplicar Pronasa, ya que después del potencial de acción, el potencial en reposo nunca se recuperó (Fig. 5a) sino hasta que se dejó de aplicar la droga (Fig. 5b).
El efecto de la TTX se debe a su alta afinidad por los canales de Na+ dependientes de voltaje, ya que ésta toxina se une a dichos canales y los bloquea en el proceso. Lo que ocurre
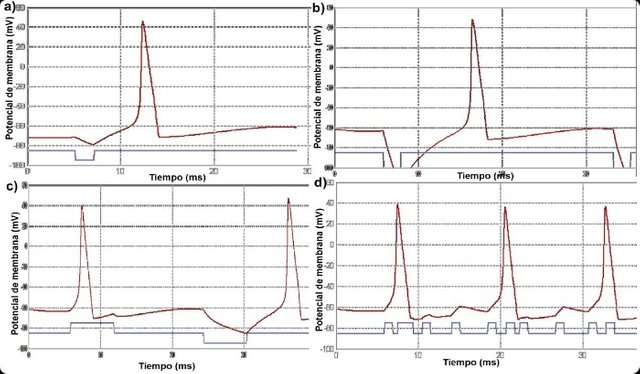
Figura 3. Gráficas de potenciales de membrana de axón de calamar vs tiempo bajo distintas condiciones. La linea roja representa el valor del potencial de membrana en mV y la azul representa el estímulo. a) Estímulo de tipo inhibitorio de -10 nA que genera hiperpolarización y retrasa el potencial de acción. b) Estímulo inhibitorio de -40 nA. Se observa hiperpolarización y un retraso en la generación del potencial de acción. c) Estímulo excitatorio seguido de uno inhibitorio, ambos de 6 ms de duración. d) Diez estímulos excitatorios que generan solo tres potenciales de acción debido al periodo refractario.
es que el extremo amino cargado positivamente de la TTX establece interacciones electroestáticas con dos anillos cargados de los residuos aminoacídicos del poro exterior del canal. Esto causa que no se genere potencial de acción ya que la membrana no se va a despolarizar, pues no habrá aporte de iones Na+ por parte de los canales dependientes de voltaje. Al aumentar el grado de inhibición en la simulación, es como si se aumentara la concentración de la toxina, de manera que al haber más toxina, habrán más canales inactivados y por consiguiente, menos probabilidad de generar potenciales de acción (Vaishali et al., 2014).
El TEA, un catión cuaternario constituido por cuatro subunidades de grupo etilo unidos a un átomo de nitrógeno central, está cargado positivamente y es afín a los canales de K+ dependientes o no de voltaje, y los bloquea. Este bloqueo impide que el potasio salga rápidamente de la célula por vía de los canales dependientes de voltaje después de la despolarización. Los iones K+ terminan saliendo a través de canales pasivos o dependientes
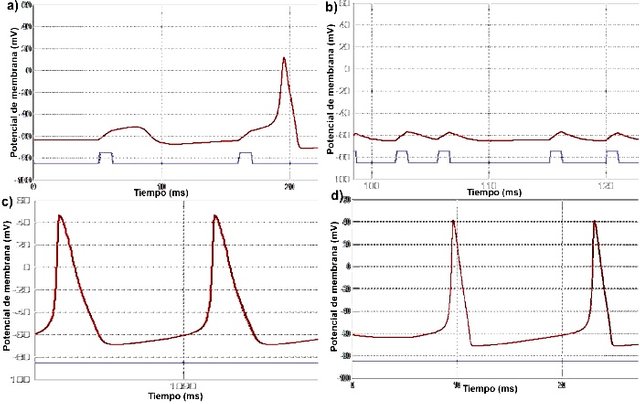
Figura 4. Gráficas de potenciales de membrana de axón de calamar vs tiempo bajo distintas condiciones. La linea roja representa el valor del potencial de membrana en mV y la azul representa el estímulo. a) Efecto de la tetrodoxina (TTX) con 50% de inhibición. Se observa dificultad y alteraciones al generarse el potencial de acción. b) TTX con 90% de inhibición. No se generan potenciales de acción. c) Efecto del tetraetilamonio (TEA) con un nivel de inhibición del 80%. Se observan retardos en la repolarización. d) Efectodel TTX con 30% de inhibición.
de voltaje que aun estén activos de manera que la célula se repolariza, pero le toma más tiempo (Fig. 4c) (Armstrong, 1971). Es por esto mismo que al bajar la inhibición al 30% la membrana de nuevo se repolariza más rápido. Además, los potenciales de acción se generan espontáneamente ya que la entrada de Na+ al interior de la célula es superada por la velocidad a la que el K+ está saliendo (influenciada por el TEA), de manera que el interior siempre está cargado por encima del umbral de voltaje. Por su parte, la pronasa es un coctel enzimático con actividad proteolítica, que hidroliza el segmento desactivador de los canales de Na+ dependientes de voltaje. De manera que al generarse un potencial de acción, los canales de Na+ permanecen abiertos, haciendo que la membrana nunca se repolarice, sino hasta que se inactivan las enzimas (Bezanilla & Arsmstrong, 1977).
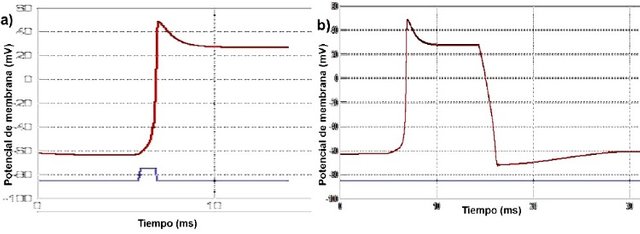
Figura 5. Gráficas de potenciales de membrana de axón de calamar vs tiempo bajo distintas condiciones. La linea roja representa el valor del potencial de membrana en mV y la azul representa el estímulo. a) Efecto de la pronasa en la generación del potencial de acción. El potencial en reposo no se recupera. b) Recuperación del potencial de acción después de que se deja de aplicar la pronasa.
3.2. Evaluación de la discriminación sensorial
3.2.1. Estimulación mecánica de los receptores de la piel en diferentes regiones del cuerpo
Las diferentes regiones del cuerpo arrojaron valores variados en cuanto a la distancia a la cual los estímulos se percibían como dos estímulos separados. Sin embargo, el estadístico de Kruskal-Wallis indicó que existían diferencias (p=0,01257) y el test de Mann-Whitney que solo existían diferencias en la distancia de percepción entre los estímulos en los dedos con respecto al resto de las partes del cuerpo, exceptuando las mejillas (Fig. 6a), que resultaron ser iguales a los dedos y al resto de las partes. En promedio, los dedos discriminan dos estímulos a una distancia de 5,00 ± 1,09 mm. Por su parte, el test de Mann-Whitney permitió comprobar que no existían diferencias (p>0,05) en cuanto a distancia de discriminación entre el género masculino y femenino, ni en la zona de los dedos ni el antebrazo (Fig. 6b). Los resultados obtenidos son similares a lo especificado en la bibliografía, en la que se sabe que en las yemas de los dedos hay gran cantidad de mecanoreceptores táctiles en comparación con el resto del cuerpo (Hill et al., 2006). Además se espera incluso encontrar que para el test realizado, los dedos presenten hasta diez veces más capacidad de discriminación que el resto de las partes del cuerpo (Alcaraz, 2001). El hecho de que no se haya encontrado diferencias entre dedos y mejillas, puede atribuirse en gran parte a que la medición en mejillas tuvo una gran desviación asociada. Convendría para este caso y para el resto emplear una muestra más grande para intentar disminuir la desviación y diferenciar o no mejor entre grupos. Finalmente, no se encuentra reportado que se hayan encontrado diferencias entre género para la discriminación táctil en las zonas de los dedos y antebrazos, lo cual se corresponde con lo encontrado.
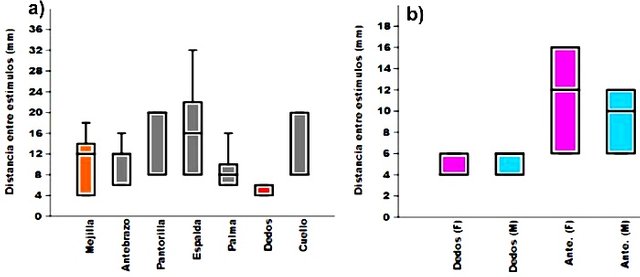
Figura 6. Gráficos de caja de las distancias entre estímulos (mm). a) Se encontraron diferencias solo entre dedos respecto al resto de las partes del cuerpo, exceptuando respecto a mejillas.b) El color azul corresponde al género masculino y el morado al femenino. Se observan las comparaciones entre géneros en función de la sensibilidad en los dedos (a la izquierda) y en los antebrazos (a la derecha). No se observan diferencias.
3.2.2. Tiempo de respuesta de Mus musculus ante una estimulación olfativa al final de un laberinto
No se encontraron diferencias para la discriminación olfativa respecto al tiempo (p=0,6161) y al número de errores (p=0,8982) en la prueba. Sin embargo, se sabe que Mus musculus posee un excelente sistema olfativo, muchas veces mejor que el del ser humano (Moulton et al., 1970). Comparación que es pertinente dado el hecho de que si los experimentadores fueron capaces de diferenciar fácilmente entre el olor a alcohol, sardina y agua, entonces muy seguramente los ratones también. Siendo esto así, los resultados obtenidos en la prueba se pueden haber visto influenciados por muchas variables externas, como el ruido, el estado de estrés de los ratones, el interés por el estímulo olfativo, entre otras muchas. Se recomienda llevar a cabo el experimento bajo condiciones mucho más controladas, y que se tomen en cuenta aspectos como la adecuación de los ratones al ambiente del experimento y la eliminación de olores en el laberinto entre pruebas. Finalmente, una muestra más grande también favorecería la obtención de resultados más confiables.
3.2.3. Intensidad del estímulo gustativo percibido por el sujeto experimental bajo diferentes concentraciones de NaCl y en diferentes regiones de la lengua
Los resultados permitieron determinar que no habían diferencias entre la intensidad del estímulo respecto a las diferentes concentraciones de NaCl en la punta de la lengua (p>0,05 para los contrastes individuales). Para la parte posterior de la lengua, si se hallaron diferencias entre todos (p=0,0124) los grupos menos el de 0,3 que resultó igual al resto. También se determinó que no existen diferencias entre las intensidades medidas en las dos regiones de la lengua en ninguna de las concentraciones. Los resultados indican que de alguna forma, la sensibilidad para distinguir la intensidad del estímulo, es igual en ambas zonas de la lengua, y que además en la punta de esta no se distinguen intensidades. Se sabe que existe una relación entre la intensidad del estímulo gustativo y la densidad de papilas gustativas en la lengua, y que además en individuos jóvenes la percepción del sabor salado es mayor en la punta de la lengua que en el resto de ésta (Matsuda & Doty, 1994). Y también se sabe que esto es debido a que en esta región se encuentran la mayor cantidad de quimiorreceptores relacionados con la discriminación de Na+ (Miller & Reedy, 1990). De modo que los resultados son muy diferentes a lo antes reportado. Esto puede deberse principalmente a que en los estudios antes realizados, la evaluación de la intensidad no es subjetiva, como lo fue en el presente estudio en la que realmente la medida era una de percepción. Además su muestra era mucho más grande. Se recomienda realizar de nuevo el ensayo, considerando una mayor población.
3.2.4. Procesamiento de la información visual e imágenes estereoscópicas
El cerebro interpreta las imágenes provenientes de los ojos de modo estereoscópico. Esto es, debido a que los ojos por su separación obtienen dos imágenes con ligeras diferencias o disparidades entre ellas. Esta disparidad es interpretada por el cerebro de manera que le da una sensación de profundidad. Por su parte, un estereograma es una ilusión óptica, que se basa en la disparidad de los ojos para que estos capten las imágenes que posee varias perspectivas, y así son procesadas luego por el cerebro como una imagen tridimensional. Sin embargo, debido a la capacidad del cerebro para corregir la disparidad, es necesario desenfocar el estereograma para poder percibirlo (Fernández−Barredo, 1991).
4. CONCLUSIONES
• La disminución de la concentración externa de Na+ hasta 50 mM causa una disminución en el potencial de reposo de la membrana del axón de calamar, y además impide la generación de potenciales de acción.
• La disminución de la concentración intracelular de K+ hasta 50 mM, causa un aumento en el potencial de reposo de la membrana hasta -20 mM e impide la generación de potenciales de acción.
• El aumento de la concentración interna de Cl- en el axón de calamar hasta 100 mM genera potenciales de acción espontáneos y continuos. En estas condiciones, el aumento hasta 100 mM de Na+ dentro de la célula elimina los potenciales de acción espontáneos, y a su vez disminuye la despolarización de los potenciales de acción causados por estímulos eléctricos desde 40 mV hasta 20 mV.
• La inactivación de los canales de Na+ dependientes de voltaje no permite la generación de potenciales de acción.
• La inactivación de los canales iónicos pasivos, generan una disminución del potencial de reposo y dificultan la generación de los potenciales de acción.
• Los estímulos inhibitorios hiperpolarizan la membrana y logran retardar la producción del potencial de acción. Si se aumenta su intensidad, aumenta la hiperpolarización y también el tiempo que se retarda el potencial de acción.
• Al aumentar el tiempo del estímulo inhibitorio, este retarda aún más la producción del potencial de acción. Mientras que al aumentar el tiempo del estímulo excitatorio es posible generar más de un potencial de acción, si el estímulo perdura hasta después del periodo refractario relativo.
• El periodo refractario y absoluto determinan el patrón de generación de un potencial de acción, independientemente de la frecuencia e intensidad de los estímulos.
• La tetradoxina evita la generación de potenciales de acción de manera progresiva en función de su concentración (% de inhibición).
• El tetraetilamonio causa potenciales de acción espontáneos y continuos con un periodo de repolarización más largo del usual. Su efecto disminuye con la concentración.
• La pronasa evita la repolarización del potencial de membrana después de un potencial de acción. Su efecto desaparece al quitarla.
• La sensibilidad o capacidad de discriminación promedio para los dedos en la muestra fue de 5,00 ± 1,09 mm, y es menor y diferente a la discriminación para el resto de las partes del cuerpo, exceptuando la mejilla que resultó tener la misma capacidad.
• No hay diferencias en cuanto a la discriminación mecanosensitiva entre géneros en la zona de dedos y antebrazos.
• No se encontró ningún indicio de discriminación olfativa en Mus musculus hacia ninguno de los estímulos (agua, alcohol, sardina) en relación al tiempo y al número de errores.
• No se encontraron diferencias en cuanto a la percepción de intensidad de la solución de NaCl entre la punta y la parte posterior de la lengua.
5. REFERENCIAS BIBLIOGRÁFICAS
• Adrian, H. (1956). The effect of internal and external potassium concentration on the membrane potential of frog muscle. J. Physiol.133: 631-658.
• Alcaráz, V. (2001). Estructura y función del sistema nervioso: recepción sensorial y estados del organismo. Editorial El Manual Moderno. México. 66 pp.
• Andara, C. & E. Sánchez. Guía de prácticas de fisiología animal. (2016). Universidad de Carabobo, Facultad de Ciencias y Tecnología, Departamento de Biología. Carabobo, Venezuela. 71 pp.
• Armstrong, C. (1971). Interaction of tetraethylammonium ion derivatives with the potassium channels of giant axons. J. Gen. Physiol. 58: 413-437.
• Bezanilla, F. & C. Armstrong. (1977). Inactivation of the Sodium Channel. J. Gen. Physiol. 70_ 549-566.
• Campbell, N., J. Reece, L. Urry, M. Cain, S. Wasserman, P. Minorsky & R. Jackson. (2014). Biology. Pearson Education, Inc. Estados Unidos de América. 1279 pp.
• Fernández−Barredo, Y. (1991). Introducción a la estereoscopia. Revista Mensual al Servicio de la Fotografía, el Cine Amateur y el Video. 478: 837-842.
• Hill, R., G. Wyse, & M. Anderson. (2006). Fisiología animal. Editorial Médica Panamericana S.A. Madrid. 916 pp. Hodgkin, L. & B. Katz. (1949). The effect of the sodium ions on the electrical activity of the giant axon of the squid. J. Physiol. 108: 37-77.
• Keynes, R. (1963). Chloride in the squid giant axon. J. Physiol. 169: 690-705.
• Lodish, H., A. Berk, C. Kaiser, M. Krieger, A. Bretscher, H. Ploegh, A. Amon & K. Martin. (2016). Molecular Cell Biology. W. H. Freeman and Company. New York. 1106 pp.
• Matsuda, T., & R. Doty.(1994). Regional taste sensitivity to NaCl: relationship to subject age, tongue locus and area of stimulation. Oxford Univeristy Press. Oxford. 89 pp.
• Miller, I. & F. Reedy. (1990). Variations in human taste bud density and taste intensity perception. Physiology & Behavior. 47: 1213-1219.
• Moulton, D., G. Celebi & R. Fink. (1970). Olfaction in mammals-two aspects: proliferation of cells in the olfactory epithelium and sensitivity to odours. Taste and smell in vertebrates. Foundation Symposium on Taste and Smell in Vertebrates. Churchill, London. 123 pp.
• Randall, D., W. Burggren & K. French. (1999). Eckert: Fisiología animal. Mecanismos y adaptaciones. McGraw-Hill Interamericana. Madrid, España. 790 pp.
• Silverthorn, D., W. Ober, C. Garrison, A. Silverthorn & B. Johnson. (2008). Fisiología Humana: Un enfoque integrado. Editorial Médica Panamericana S.A. Madrid. 860 pp.
• Touretzky, D., M. Albert, N. Daw, A. Ladsariya & M. Bonakdarpour. (2008). HHsim: Graphical Hodgkin-Huxley Simulator. Disponible en: http://www.cs.cmu.edu/~dst/HHsim
• Vaishali, B., M. Lehane, M. Dicshit, A. Riordan, & A. Furey. (2014). Tetrodoxin: Chemistry, toxicity, source, distribution and detection. Toxins. 6: 693-775.
Hi @khrisaeroth!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
¡Felicidades, #proconocimiento te valoró!
Has sido reconocido(a) por tu buen post por el Comité de Arbitraje y Valoración del Proyecto Conocimiento @proconocimiento.
Apoyamos y valoramos tu esfuerzo...
Proyecto Conocimiento es parte de la comunidad @provenezuela.
Pioneros en la plataforma #steemit en el reconocimiento y valoración a la Producción Intelectual en habla hispana.
¡Muchísimas gracias!
Ciencia bien sustentada y que nos ayuda a comprender los procesos de los sentidos humanos, ¡Ovación de pie..!
Aún siendo estudiados consecuentemente, todavía hay algunas cosas que no comprendemos sobre los sentidos del ser humano, por ello es necesario continuar haciendo ciencia..! ¡Votado por Engranaje!
de verdad una muy buena pieza de ciencia muy bien detallada.
Aportes importantes para esta comunidad, felicitaciones @khrisaeroth
Buena vibra.
Excelente!