¡Hola amigos de steemit! Reciban un caluroso abrazo de mi parte, quizás muchos de uds ya me conocen por mis publicaciones referentes a la química. Esta interesante rama de la ciencia que me apasiona y que decidí tomar por carrera, motivado por la curiosidad que siempre causaron en mis diversos fenómenos que ocurren en la naturaleza, en mí búsqueda de respuesta a interrogantes como: ¿Porque el hielo flota en el agua? ¿A qué se debe que un compuesto pueda ebullir a temperaturas diferentes en distintos lugares? ¿Cómo fluye el agua hasta la copa de los arboles? ¿Por qué hay sustancias que no se mezclas con otras? ¿Cómo pueden algunos insectos caminar sobre el agua? ¿Por qué se oxidan los metales? entre muchas más.
Al empezar a adentrarme en el fascinante mundo de la química, estas dudas poco a poco fueron aclaradas de manera paulatina. Uno de los temas que más llamó mi atención durante mis estudios fue el de las fuerzas intermoleculares, a continuación les explicare el porque.
¿Qué son las fuerzas intermoleculares?
Las sustancias o compuestos están constituidos por moléculas. Una molécula conjuga la unión de dos o más átomos que buscan a través del compartimiento de electrones la estabilidad química, sin embargo al lograr esta estabilidad se genera cierta polaridad en su estructura, por la distribución electrónica asociada al proceso, lo que propicia su interacción con las otras moléculas formadas en el compuesto y las mantiene unidas unas con otras.
Moléculas y fuerzas intermoleculares
 Fuente
Fuente
Estas interacciones que ocurren entre las moléculas de un compuesto son las que se denominan Fuerzas intermoleculares. Y tienen una importante influencia en las propiedades físicas de los compuestos, es por ellos que a través de la misma se pueden responder muchas de las interrogantes anteriormente formuladas.
Pero para profundizar más en relación o influencia de estas interacciones con las propiedades físicas de los compuestos, veamos primero como se clasifican las fuerzas moleculares.

Clasificación de las fuerzas intermoleculares.
Fuerzas ion-dipolo:
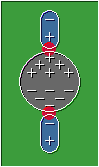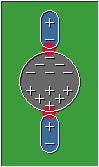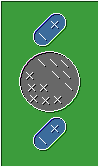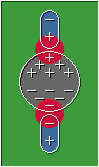
Son las interacciones que ocurren entre un ion y una molécula de naturaleza polar, la molécula polar al presentar carga parcial positiva en uno de sus extremos y carga negativa en el otro, formara un dipolo que atraerá los aniones desde su lado positivo, y, los cationes desde el negativo.
Interacción entre una molécula polar y un ion
![molecule-ion[1].gif](https://steemitimages.com/0x0/https://cdn.steemitimages.com/DQmXh6rEkRcYs8gNSdPNNxToHBHBvRon8XBRXv7DxgJV24D/molecule-ion[1].gif) Fuente
Fuente
Un ejemplo de ello es la disolución del cloruro de sodio en agua, en donde la molécula del agua atraerá por su extremo positivo a los iones cloruros disueltos, los cationes en este caso representados por el sodio serán atraídos por el extremo de carga negativa en la molécula de agua.
Hidratación o solvatación del cloruro de sodio
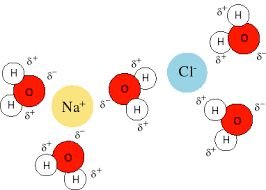 Fuente
Fuente
Fuerzas dipolo-dipolo:
Se refiere a la atracciones que ocurren entre la moléculas polares, estas al formar dipolos atraerán a los extremos con cargas opuestas de las moléculas vecinas.
Moléculas polares interactuando
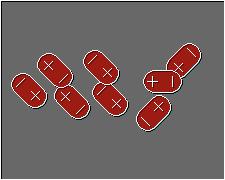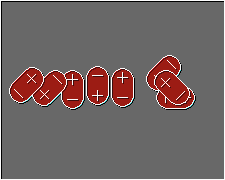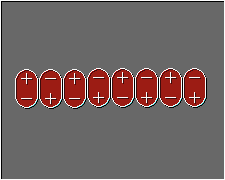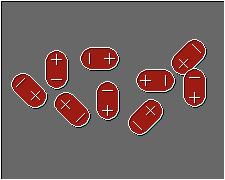 Fuente
Fuente
El ácido clorhídrico es de naturaleza polar y sus moléculas interactúan unas con otras, siendo atraídos los extremos positivos donde se el encuentra el hidrógeno, por los extremos de los cloruros que representan la cargas negativas de la molécula.
Atracción entre las moléculas del HCl
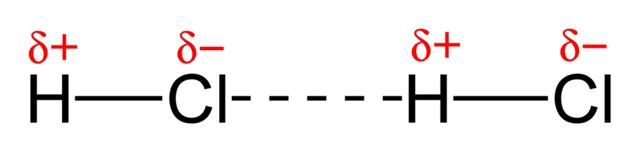 Fuente
Fuente
Fuerzas de dispersión de London o de dipolo inducido:
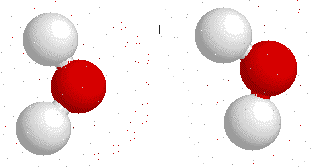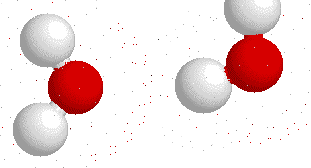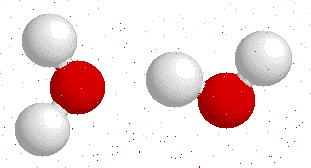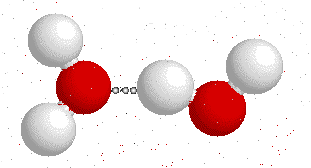
Son las interacciones que surgen entre las moléculas no polares, se originan al formarse dipolos momentáneos producto de la rotación molecular.
Estas moléculas a pesar de no presentar una marcada diferencia de electronegatividad entre sus elementos constituyentes, tienden a formar dipolos momentáneos cuando su densidad electrónica es repelida o atraída por las cargas parciales de otras moléculas, lo que produce un efecto en cadena como se muestra en la siguiente imagen.
Formación de dipolos inducidos
 Fuente
Fuente
Las fuerzas de dispersión de london ganan intensidad a medida que el tamaño de las moléculas es mayor, ya que esto facilita la formación dipolar. Esto queda demostrado en muchos compuestos orgánicos por ejemplo en los alcanos, que a medida que aumenta el tamaño de la molécula, mayor sera su punto de ebullición, los primeros 4 alcanos se encuentran en estado natural en forma de gas, mientras que a medida que avanzan en el numero de carbonos en la molécula se vuelven líquidos y resinosos, hasta formar ceras parafínicas.
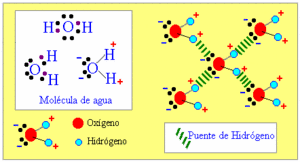
Fuerzas de puente de hidrógeno:
Son las interacciones especiales de atracción que ocurren entre los átomos del hidrógeno con los átomos electronegativos del Oxígeno, Flúor y Nitrógeno, mientras más electronegativo sea, mayor sera la atracción al hidrógeno.
En la molécula del agua, el oxigeno sera atraído por los átomos de hidrógeno de las moléculas vecinas.
Moléculas de agua atraídas por los puentes de hidrógeno
 Fuente
Fuente
De esta manera las moléculas se agrupan y quedan espacios huecos entre ellas, por tal motivo ocurre el fenómeno de que el hielo presenta una menor densidad que el agua en su estado líquido, y por consiguiente el hielo flota en el agua. Los puentes de hidrógeno le confieren al agua muchas de las propiedades que hacen posible que esta pueda albergar vida.
 Fuente
Fuente

Relación entre las fuerza intermoleculares y las propiedades físicas de los compuestos.
Esta es la razón por la cual las fuerzas intermoleculares son de mis temas favoritos en química, es impresionante la incidencia que estas pueden tener en conjunto con el tamaño y estructura de las moléculas en las propiedades fisicoquímicas de los compuestos.
A continuación se muestra de forma resumida el efecto de las fuerzas moleculares sobre algunas propiedades.
Punto de ebullición: Para que una sustancia pueda ebullir, pasando del estado liquido al gaseoso, es necesario romper las fuerzas de atracción que mantienen unidas a las moléculas, si estas interacciones son fuertes el punto de ebullición de la sustancia sera alto debido a que necesitara más energía para vencer dichas magnitudes, si por el contrario son débiles el punto de ebullición sera bajo.
Viscosidad: Esta propiedad se define como la resistencia a fluir que presenta determinado compuesto, por tal motivo al existir una mayor atracción entre las moléculas, estas permanecerán más unidas unas con otras y su viscosidad sera mayor. Esta propiedad también se ve afectada por el tamaño de las moléculas, moléculas mas grandes ofrecen mayor resistencia a fluir.
Tensión superficial: Se refiere a la fuerza ejercida desde la superficie al interior de un líquido para mantener a las moléculas lo mas cerca unas de otras, la formación de gotas se debe a esta propiedad, ya que la sustancia busca reagruparse ocupando el menor área posible. Gracias a esta característica de fuerzas internas en el agua, es que los insectos pueden caminar en ella y que podemos navegar lagos, ríos y mares. Además es la responsable del efecto de capilaridad que permite que el agua suba por el interior de los arboles.
Solubilidad: Variará de una sustancia a otra dependiendo de su naturaleza, las sustancia polares disolverán sustancias polares, y la no polares sustancias no polares. Todo esto producto de la interacciones que puedan establecer unas con otras.
Densidad: No es mas que una relación entre la masa y el volumen, mientras más unidas se encuentren moléculas de una sustancia habrá menos espacios entre ellas, por tal motivo es de suponer que su densidad sea mayor. Solo el agua es la excepción a esta regla ya que en estado solido es menos densa que el estado liquido, producto del ordenamiento molecular propiciado por los puentes de hidrógeno.
Presión de Vapor: se refiere a la presión ejercida por las moléculas de un líquido para pasar al estado gaseoso, esta relacionada con el punto de ebullición, ya que cuando la presión de vapor de una sustancia se iguala a la del ambiente, esta ebulle. Por eso mientas más intensas sean las fuerzas intermoleculares de un compuesto, menor sera su presión de vapor, es decir que es inversamente proporcional a las fuerzas que mantienen unidas a las moléculas.
 Acá les dejo este vídeo complementario bajado de youtube sobre los fundamentos teóricos de las fuerzas moleculares.
Acá les dejo este vídeo complementario bajado de youtube sobre los fundamentos teóricos de las fuerzas moleculares.


![molecule-ion[1].gif](https://steemitimages.com/0x0/https://cdn.steemitimages.com/DQmXh6rEkRcYs8gNSdPNNxToHBHBvRon8XBRXv7DxgJV24D/molecule-ion[1].gif)










@joseleogon you were flagged by a worthless gang of trolls, so, I gave you an upvote to counteract it! Enjoy!!
Saludos amigo, como siempre muy bien explicado el tema. Ciertamente que estas fuerzas definen las propiedades físicas de las sustancias, sobre todo los puentes de hidrogeno que le confieren al agua sus caracteristicas, que son tan necesarias para la vida.
¡Saludos hermano! Muchas gracias por estar siempre atento a mis publicaciones. Las fuerzas intermoleculares son las que definen el comportamiento de las sustancias con su entorno.
Las fuerzas intermoleculares están presentes en todos los cambios físicos de los materiales, desde la disolución del azúcar en agua hasta la condensación del agua en la atmósfera y aún mas allá. Muy bueno tu post, te estaré siguiendo. Saludos
Así es estimada @arianadelg, las fuerzas intermoleculares influyen en todas estas propiedades y es allí donde radica la importancia de su estudio, ya que permiten conocer la naturaleza de diversas sustancias.
¡Felicidades, #proconocimiento te valoró!
Has sido reconocido(a) por tu buen post por el Comité de Arbitraje y Valoración del Proyecto Conocimiento @proconocimiento.
Apoyamos y valoramos tu esfuerzo...
Proyecto Conocimiento es parte de la comunidad @provenezuela.
Pioneros en la plataforma #steemit en el reconocimiento y valoración a la Producción Intelectual en habla hispana.
Muchas gracias @proconocimiento y @provenezuela por la excelente labor que realizan, apoyando la generación de contenidos que enriquecen en conocimiento a la comunidad.
Me siento honrando por este reconocimiento el cual me motiva a seguir compartiendo información en la comunidad, con la certeza de que tendrá la receptividad de usuarios y comunidades como la de uds. ¡Saludos!
Tienes mucha facilidad para hacer accesible conocimiento que tradicionalmente parece complicado para la mayoría. Gran post.
This post has received a 1.49 % upvote from @booster thanks to: @joseleogon.