[Ciencia] Grupos protectores. Acetilación de grupo amino de la p-toluidina.
Resumen
Introducción
Los grupos protectores han sido de gran importancia para la síntesis orgánica, debido a que ayudan al experimentador a poder llevar a cabo reacciones en su molécula sin afectar grupos funcionales que normalmente reaccionarían en las condiciones a las que se aplica la reacción. Grupos como las aminas, los carbonilos tanto en las cetonas como en los aldehídos, así como otros grupos son susceptibles a ataques o substituciones, considerando la reactividad de algunos núcleos o que puedan fungir como buen grupo saliente ante algún ataque. Precisamente esta cualidad de evitar que ocurran reacciones indeseadas es la que hace que los grupos protectores sean de gran importancia en la química orgánica, pero al ser reacciones secundarias cuyo producto solo es de interés por una reacción posterior, su reversibilidad es importante.
Uno de las maneras más comunes de proteger grupos aminas en las moléculas orgánicas es a través de la acetilación, que deriva en la formación de una amida, reacción catalizada por ácido en la cual se pasa de un grupo amina el cual puede ser un buen grupo saliente para una sustitución nucleofílica aromática a ser un grupo poco reactivo y estable.
En el caso de esta práctica se realizó la protección del grupo amina de la para-toulidina, que en condiciones de laboratorio es un sólido blanco parcialmente soluble en agua, al acetilarla con anhídrido acético. Este método de protección es común en el caso de que se quiera funcionalizar alguna otra posición del anillo aromático, como podría ser la nitración, considerando el hecho de que la reacción es reversible en medio acuoso muy ácido.
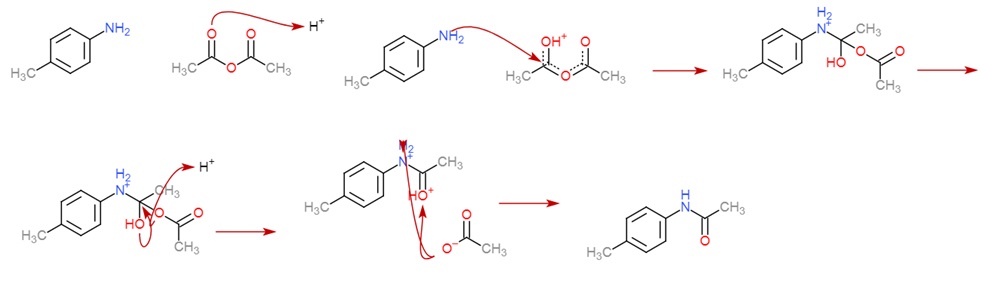
El paso principal del mecanismo es el ataque del grupo amino al carbonilo del anhídrido acético, formando así el enlace entre el nitrógeno y el acetato, que constituye la parte fundamental de la acetilación y protección de la molécula. El mecanismo es expresado en la figura N°1.
Figura N°1. Mecanismo de acetilación del grupo amino de la p-toulidina.
Resultados
En primera instancia se diluyeron 0.520 ± 0.001 gramos de p-toulidina en 12.5mL de agua con 1mL de HCl concentrado, luego se le añadieron 1mL de anhídrido acético seguido de 1.5g de acetado de sodio en 2.5mL diluidos en 2.5mL de agua en calentamiento. No se observó precipitación a pesar de introducir la solución en un baño de hielo. Posteriormente se repitió el experimento cambiando la cantidad de agua en la que se diluyó al p-toulidina de 12.5mL a 25mL, manteniendo el resto de las soluciones iguales y se observó un precipitado formado por cristales blancos, al cual se sometió a un baño de hielo y fue filtrado al vacío y secado durante 24 horas. Este tuvo una masa de 0.513 ± 0.001g se midió su punto de fusión dos veces y este resultó ser 146 ± 1 C° y 147 ± 1 C°
Discusión
La precipitación del reactivo atiende a la formación de la N-acetil-para-toulidina, producto de la reacción del grupo amino con el anhídrido acético, el cual es insoluble en medio acuoso a menos que se protone el grupo amino formando la especie iónica, la cual sí es soluble en agua. De igual forma el punto de fusión se acerca a la ventana del N-acetil-p-toulidina, la cual es de 149C° a 151C°, la ligera desviación pudiese ser causada por la coprecipitación de algún reactivo o producto secundario, considerando el exceso de acetato de sodio pudiese tratarse de él, pero para determinarlo se tendría que hacer estudios espectroscópicos.
Se pudiese explicar la ausencia de precipitado al utilizar solo 12.5mL de agua para disolver la p-toulidina al considerar la concentración de ácido a la cual iba a ser llevada a cabo la reacción general, teniendo en cuenta que esta iba a ser el doble que la concentración de ácido a la cual precipitó el producto al tener la mitad del volumen. Esto se puede deber a que el pH fue muy alto para realizar el ataque nucleofílico necesario para la formación del producto, y que el equilibrio de este estaba desplazado hacia los reactivos al haber una concentración de ácido tan alta. La solución encontrada fue aumentar el volumen y permitir que la concentración de ácido fuese menor, para que la reacción pudiese llevarse a cabo.
Esto va en concordancia de igual manera con la manera de revertir el equilibrio para desproteger el grupo amino, el cual está relacionado con altas concentraciones de ácido.
Conclusión
Se logró proteger grupo amino de la p-toulidina al acetilarlo con anhídrido acético y aislarlo en forma de cristales, obteniendo un rendimiento de (70.7 ± 0.2)% y un punto de fusión de 145 ± 1C° lo cual indica la presencia de impurezas en bajas proporciones considerando que los límites de fusión de la N-aceto-p-toulidina están entre 149-151C°. De igual forma se observaron los efectos de las altas concentraciones en la síntesis y el impedimento que conllevan a la formación del grupo acetilado, se llegó a la conclusión de que la protonación del grupo amina la cual impide la iniciación de la reacción.
Referencias
Pavia, D. Lampman, D. Kriz, D. and Engel, R. (2016) “A Microscale Approach to Organic Laboratory Techniques.” Cengage Learning, sixth ed.
Wade, L (2002) “Química orgánica” España. Editorial Pearson.
Watson, W (1999) “protecting gropus in Organic Synthesis” American Chemical Society. Vol 64.
Krubsack, D. (1973) “Experimental organic chemistry.” Allyn and Bacon chemistry series, Allyn and Bacon.
Being A SteemStem Member
Felicidades!

Únete a nuestro canal en discord y así puedes interactuar con toda la comunidad de habla hispana te esperamos!
https://discordapp.com/channels/354702649360121857/407281009130733578