Saggio alla fiamma
Uno degli esperimenti scientifici più semplici e più belli del liceo è quello che solitamente si fa al primo anno, quando si studia la struttura fondamentale dell'atomo. È di grande impatto visivo, nonostante sia passato qualche anno me lo ricordo molto bene. Parliamo del cosiddetto "saggio alla fiamma".
La sua preparazione è molto semplice: basta prendere un becco bunsen, ovvero un bruciatore a gas che serve a generare una fiamma molto stabile (poco soggetta a fluttuazioni e poco incline a spegnersi), ma regolabile.

un becco bunsen (fonte)
Servono poi:
- una bacchetta di vetro che termina con un filo di platino oppure nichel-cromo
- una soluzione di acido cloridrico (HCl)
- composti di varia natura: cloruro di potassio, cloruro di sodio, cloruro di litio...
Lo svolgimento dell'esperimento è altrettanto semplice:
immergere il filo di platino nell'acido cloridrico. Una volta fatto, toccare con il filo il composto di nostro interesse, facendo in modo che un po' di esso si depositi sul filo stesso.
A questo punto porre il filo in mezzo alla fiamma viva. Osservare e prendere nota. Ripetere l'esperimento in diversi punti della fiamma e con diverse sostanze.
Cosa notiamo?
Notiamo che quando tocchiamo la fiamma con il filo, questa si colora, in modo molto caratteristico. Salta subito all'occhio che questo colore non è lo stesso per tutte le sostanze. Ad esempio:

litio (fonte)

sodio (fonte)

rame (fonte)

antimonio (fonte)
A volte vediamo il verde, a volte il rosso, a volte il viola, a volte l'arancione...
Adesso dobbiamo rispondere alle domande: perchè la fiamma si colora? Perchè il colore cambia da sostanza a sostanza?
Per farlo, dobbiamo proprio studiare la struttura dell'atomo
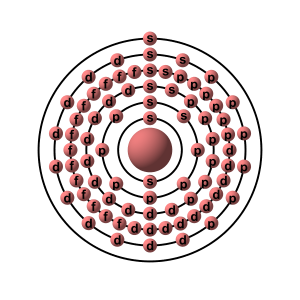
Un atomo è un oggettino formato da un nucleo e da elettroni che gli girano attorno. Il nucleo è formato a sua volta da protoni e neutroni. Il numero di protoni determina l'elemento: se l'atomo ha 1 protone si parla di idrogeno, con 2 protoni abbiamo l'elio, con 79 l'oro, e così via...ogni diverso elemento ha un differente numero di protoni. I protoni possiedono carica positiva, gli elettroni negativa. Schematicamente, un atomo di può rappresentare così:
(fonte)
Questo è un modello "classico" dell'atomo, precisamente dell'atomo di oro. Sono disegnate le "orbite" degli elettroni,anche se sarebbe più corretto parlare di orbitali, cioè regioni dove la probabilità di trovare un elettrone è massima. Ma questa è un'altra storia, un altro post. D'ora in avanti userò il termine "orbita" ma sappiate che è un'imprecisione, che può solo dare un'idea di quello che succede nell'atomo.
Adesso concentriamoci sugli elettroni attorno al nucleo. Questi non possono orbitare a una distanza qualsiasi: esistono ben precise orbite permesse, a ben precise distanze dal nucleo, che corrispondono a precisi livelli di energia. L'orbita più vicina al nucleo è quella a più basso livello energetico. All'aumentare della distanza dal nucleo, l'energia dell'orbita aumenta. Cosa significa? Significa che se io voglio spostare un elettrone da un orbita più bassa a una più alta, dovrò fornirgli energia. Ma non un'energia qualsiasi: dovrò fornire almeno la differenza di energia tra le due orbite. È quello che succede quando poniamo il filo di platino in mezzo alla fiamma: l'energia termica eccita gli elettroni e li spinge in un'orbita più energetica.
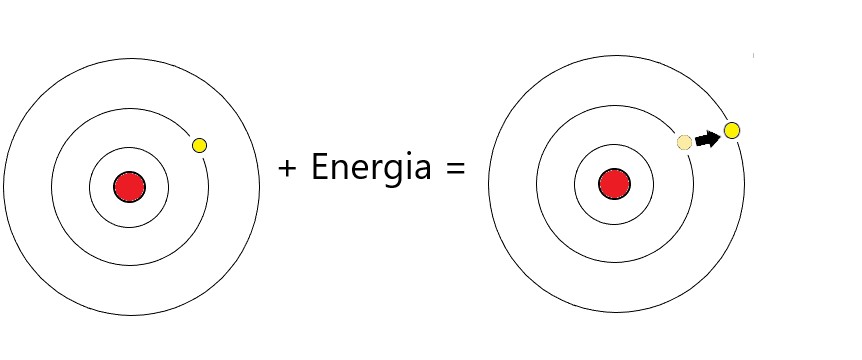
L'universo però è piuttosto "pigro". Detto meglio, tutti i fenomeni naturali hanno la tendenza a raggiungere uno stato di equilibrio con il resto dell'ambiente. Questo stato viene raggiunto quando l'energia dell'oggetto/fenomeno in questione è la minima possibile. È una caratteristica dell'universo che si verifica empiricamente: le cose funzionano così. Questo è il motivo per cui i pianeti sono sferici, ma è anche il motivo che provoca la ricaduta quasi immediata (si parla di miliardesimi di secondo) dell'elettrone sull'orbita di energia più bassa dalla quale era partito! Per poterlo fare però deve disfarsi dell'energia in eccesso, e lo fa sotto forma di fotoni, (di luce) che colorano la fiamma. L'energia del singolo fotone emesso dall'elettrone è pari alla differenza energetica delle due orbite. E questo è interessante, perchè significa che lo spettro di emissione non sarà continuo, ma verranno emesse solo certe frequenze di luce, con un valore di energia definito.
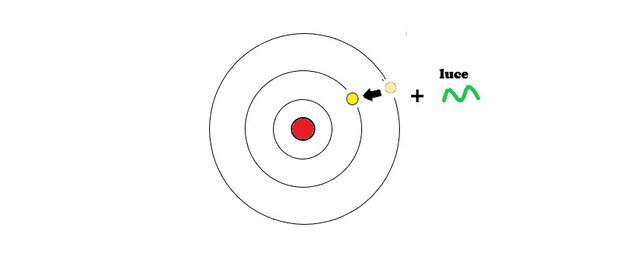
I fotoni più energetici sono viola, quelli meno energetici sono rossi. In mezzo ci stanno tutti i gli altri colori, di energia crescente secondo questo schema
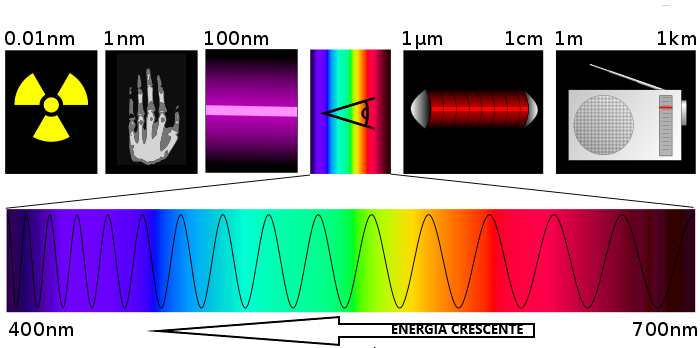
modificato da questa immagine
Ovviamente è possibile che vengano emessi fotoni più/meno energetici che non siamo in grado di rilevare con gli occhi. Ogni diverso elemento ha differenti livelli energetici, perciò rilascia una propria luce caratteristica. Questo ci dà un metodo per condurre un'analisi qualitativa dei composti chimici! Analizzando la luce che emettono possiamo capire di cosa sono fatti. La tecnica è nota con il nome di "spettroscopia"
Questo metodo viene utilizzato per esempio per determinare la composizione chimica delle stelle, ma in generale di una vastissima gamma di sostanze.
Inoltre, il colore dell'oggetto indica anche la sua temperatura: un pezzo di metallo incandescente assume un colore rosso, ma se aumentiamo ancora la sua temperatura assumerà una colorazione tendente all'arancione. Guarda caso, fornendo più energia otteniamo un'emissione di fotoni più energetici. Andate a rileggere la procedura per lo svolgimento dell'esperimento. Non a caso si dice di provare in punti diversi della fiamma: a seconda della zona, la sua temperatura è diversa (circa 300 °C alla base, 1400 °C al centro) e di conseguenza gli elettroni verranno spediti su differenti orbite. Quindi possiamo ottenere diverse colorazioni anche dallo stesso elemento. Però la "tonalità" del colore emesso è unica da elemento a elemento.
Approfondimenti
La serie di Balmer. Altro non è che una serie di linee che descrivono lo spettro di emissione dell'idrogeno, per elettroni che passano dal livello energetico n a livello 2, dove n è un numero naturale maggiore o uguale a 3. Eccola:

(fonte)
La formula matematica empirica permette di calcolare le varie lunghezze d'onda è la seguente:
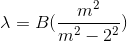
dove lambda è la lunghezza d'onda, B è una costante che vale 3.6456×10-7 m, n indica anche il numero quantico principale, ovvero l'energia dell'orbitale.
La formula è stata generalizzata da Rydeberg. È valida per qualsiasi transizione dell'idrogeno da un livello n2 a un livello n1. Eccola:
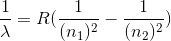
dove R è la costante di Rydeberg, che vale 10,973,735.3 m−1
Le costanti in gioco sono state inizialmente determinate sperimentalmente, ma possono essere calcolate anche teoricamente, utilizzando il modello atomico di Bhor.
Una generalizzazione ancora maggiore della formula di Rydeberg, valida per qualsiasi elemento è la seguente:
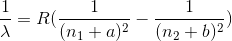
dove a e b sono parametri caratteristici dell'atomo in questione.
Lo spettro di Balmer è molto importante in astronomia, perchè le sue righe di emissione sono molto frequenti nei fenomeni astronomici.
Tramite tecniche di spettroscopia vengono anche analizzate le atmosfere dei pianeti per rivelare i gas costituenti. Questo è molto importante per la ricerca di vita extraterreste, perchè esistono gas/composti prodotti dagli esseri viventi che si degradano naturalmente con il tempo. Se vengono osservate tracce di quei gas laddove non dovrebbero esserci, significa che c'è una sorgente che li produce in modo costante nel tempo, e questo potrebbe essere un indizio sul fatto che su quel pianeta c'è vita. Allo stato attuale della tecnologia è impossibile esaminare i pianeti che orbitano attorno ad altre stelle, ma una speranza in questo senso arriverà dal telescopio spaziale James Webb, che verrà lanciato (si spera!) nel 2018. Esaminerà la luce infrarossa, e la speranza è che possa riuscire ad analizzare anche la luce proveniente da pianeti lontani. Un altro progetto di questo tipo è l'European Extremely Large Telescope, un telescopio che avrà uno specchio primario di 39 metri di diametro. Dovrebbe entrare in funzione nel 2024, speriamo bene. Al di là di questo, la spettroscopia è utilizzata, ad esempio: per determinare la velocità di rilascio di un farmaco, o la velocità di una reazione chimica
per rivelare impurezze nel composto (es. nell'analisi ambientale)
per la manutenzione delle opere d'arte.
e tante altre cose...
Ciao ciao!
Fonti: https://it.wikipedia.org/wiki/Serie_di_Balmer https://it.wikipedia.org/wiki/Saggio_alla_fiamma http://www.chimica-online.it/laboratorio/saggi-fiamma.htm http://www.bisceglia.eu/chimica/lab/saggif.html
http://www.chimicamo.org/chimica-analitica/applicazioni-della-spettroscopia-uvvisibile.html http://www.uniroma2.it/didattica/MA2/deposito/spettroscopia_UV.pdf
Testo carteceo: http://online.scuola.zanichelli.it/atkinschimica/chimica-di-atkins/
Tutte le immagini sono tratte da Wikipedia, o create da me.
Che bello!Ottimo post!
Grande! Il tuo post mi e' piaciuto molto!
Congratulations @rscalabrini! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on any badge to view your own Board of Honor on SteemitBoard.
For more information about SteemitBoard, click here
If you no longer want to receive notifications, reply to this comment with the word
STOPQuest'articolo e' stato votato anche da @steemstem. SteemSTEM e' un progetto che aiuta a divulgare la scienza su Steemit