Sábado de Ciencias | ¿Por qué se oxida el hierro?
Recientemente estaba observando las rejas del portón y unas ventanas de mi casa, sé que ya necesitan una mano de pintura pero quería evaluar que tan mal estaban, vivo en una zona costera por lo que el ambiente salino obliga a que se les realice un mantenimiento periódico, eso me llevo a compartir con ustedes este análisis del por qué se oxida el hierro.

Las rejas de hierro que necesitan mantenimiento. Fuente: @emiliomoron.
Si consideramos el costo actual de la pintura, el fondo anticorrosivo y los materiales necesarios para repintar las protecciones de hierro de nuestro hogar o proteger cualquier estructura metálica, nos daremos cuenta que el tema de la oxidación del hierro es muy importante ya que deteriora las propiedades mecánicas de las estructuras además de su aspecto visual, por lo que este fenómeno puede representar un gran impacto económico para nosotros.
Entonces, ¿por qué se oxida el hierro?
Debemos empezar por definir algunos aspectos, primeramente podemos decir que de cierta forma la oxidación del hierro es inevitable, salvo algunas excepciones como el oro y el platino, los metales no existen en la naturaleza en su estado puro, sino en combinación con algún otro elemento, formando minerales como óxidos, carbonatos o sulfatos. Precisamente por eso cuando se produce el acero en las siderúrgicas se requieren grandes cantidades de energía para liberar el hierro del resto de los elementos con los cuales se encuentra combinado, así que la oxidación puede verse como un retorno de los metales a su estado natural.
Para retornar a este estado se requiere de una reacción química denominada redox o de óxido-reducción, un tipo de reacción química donde los elementos y compuestos intercambian electrones de forma tal que el estado de oxidación de cada uno aumenta o disminuye.
Por ejemplo, en el caso del hierro cuando se oxida en presencia de oxígeno pasa de su estado de oxidación 0 a +2, debido a la transferencia de dos electrones al oxígeno que cambia su estado de oxidación de 0 a -2. Recordemos que los electrones tienen carga negativa, así que la especie que los pierde se vuelve más positiva y la que los recibe se vuelve más negativa.
De forma general podemos representar la reacción como:
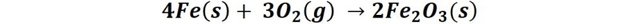
Vamos a explicarlo con un experimento
Vamos a probar la oxidación del hierro de forma muy sencilla, solo vamos a necesitar un clavo de hierro (libre de óxido), un plato de plástico desechable y un poco de agua. En el plato vamos a colocar el clavo de hierro y le vamos a agregar un poco de agua, suficiente para dejar parte de la superficie del clavo expuesta.

Condición inicial del esperimento. Fuente: @emiliomoron.
El agua común contiene algunas sales y oxígeno disuelto, por lo que al cabo de algunas horas comenzamos a observar que el agua en las proximidades del clavo se va tornando de un color naranja, lo que nos da indicios de que la reacción de oxidación ha iniciado.

Después de unas horas ya se observan señales de oxidación. Fuente: @emiliomoron.
Esta reacción se lleva a cabo básicamente porque en el clavo se producen algunas zonas que funcionan como pequeñas celdas electroquímicas, por un lado, en algunas zonas se produce la reacción de oxidación (zonas anódicas) y en otras zonas la reacción de reducción (zonas catódicas).
En las zonas anódicas se produce la oxidación del hierro según la semireacción:
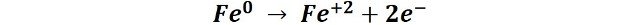
Y en las zonas catódicas se produce la reducción del oxígeno:
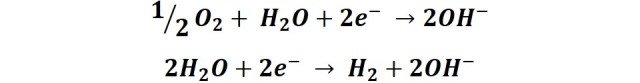
En la siguiente figura podemos observar una representación del proceso.
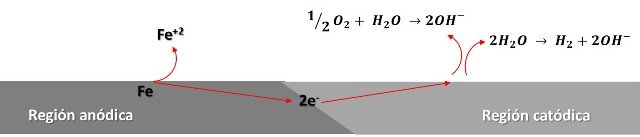
Representación de las reacciones que se producen en la superficie del clavo. Fuente: @emiliomoron.
Por lo general las zonas catódicas suelen ubicarse donde la concentración de oxígeno es mayor y las zonas anódicas suelen ubicarse donde la concentración de oxígeno es menor, esto es común en el ambiente ya que la superficie del metal expuesta a la atmosfera puede variar, por ejemplo; lo que ocurre cuando tenemos parte del clavo sumergido en el agua, como la concentración de oxígeno es mayor en la superficie expuesta al aire en esta tendera a ubicarse la zona catódica, no observándose tanta oxidación en esta parte. Y las zonas anódicas estarán preferiblemente ubicadas en la superficie sumergida, con menor concentración de oxígeno, produciéndose la oxidación del clavo en esta parte, disolviendo los iones hierro en la solución.
En el agua, con un pH cercano al neutro, y en presencia de oxígeno, la reacción global de oxidación del clavo puede representarse de la siguiente forma:
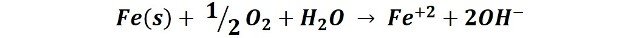
Luego, los iones hierro Fe+2 reaccionan con el oxígeno disuelto del agua produciendo un precipitado de óxido férrico hidratado, de color naranja rojizo.
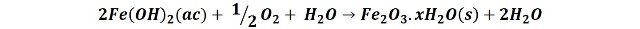
Por ello, con el transcurrir del tiempo el clavo se oxida convirtiéndose en óxido férrico. En las siguientes imágenes podemos comparar como se va coloreando la disolución con el óxido férrico a medida que transcurre el tiempo del experimento.
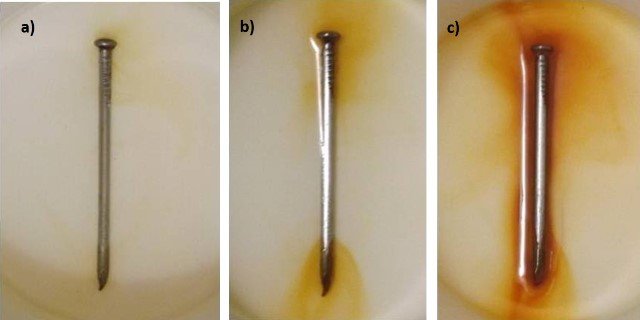
Avance de la oxidación durante el experimento. Fuente: @emiliomoron.
En la siguiente imagen podemos observar el agua recolectada del plato, el precipitado de aspecto coloidal de color rojizo es el óxido férrico hidratado, luego de algunas horas se puede ver que este se deposita en el fondo del recipiente.

Precipitado del óxido recogido del plato. Fuente: @emiliomoron.
Este mismo sólido rojizo es el que se deposita sobre las piezas de hierro en el ambiente, seguro que más de uno de nosotros recordara en este momento haberse manchado las manos con un sólido rojizo al tocar una pieza de hierro oxidado.

Manchas de óxido de hierro en los dedos. Fuente: @emiliomoron.
Eso se debe a que las capas de óxido se desprenden con facilidad debido a que el proceso de oxidación no se detiene solo en la superficie, sino que prosigue desprendiendo poco a poco el material, así, con el paso el tiempo se convertirá en óxido la totalidad de la pieza y vemos cómo se va deteriorando. Y el ambiente salino solo acelera el proceso, ya que las sales disueltas facilitan la conducción electrica en el medio, facilitando la transferencia de electrones y acelerando la reacción de oxidación.
Bueno amigos, es todo por los momentos, espero que la información les sea útil, muchas gracias por pasar a leer el post. ¡Hasta el próximo!
Gracias por ser parte de la Comunidad Oficial Steem Venezuela, tu publicación ha sido recompensada por La cuenta Comunitaria @hive-193637 de la Comunidad Oficial Steem Venezuela.
Esperamos tu aporte al crecimiento de La comunidad haz tu delegación a nuestra Cuenta comunitaria Steem Venezuela, haz Clic a los siguientes enlaces:
50 SP 100 SP 250 SP 500 SP 1000 SP
2500 SP
UNIDOS SOMOS MÁS FUERTES!
Gracias amigos!
Hola querido amigo@emiliomoron(66); gracias por compartir tan valiosa información .
Hola @mamayin, gracias a ti por pasar a leer, saludos.
Amigo @emiliomoron, me parece excelente que hayas compartido con nosotros este fenómeno con conceptos y experimento incluído, inlcusive me hiciste recordar qu eyo también debo retocar y retirar el óxido de las rejas en casa, jejeje
Hasta pronto
#affable
Hola amiga @tocho2, es un placer haber compartido la información, me alegra que te gustara, seguro recordaras porque se oxidaron las rejas cuando las estes retocando jeje. Saludos y gracias por pasar a leer.
Un excelente publicación, es increíble lo fácil que se dio el proceso de la oxidación en tu experimento.
Gracias por participar el sábado de ciencias.
#affable #venezuela
Hola @anasuleidy, muchas gracias, realmenta la oxidación del hierro es muy rápida. Mucgas gracias a ti por pasar a leer, saludos!
Gracias por ser parte de la Comunidad Oficial Steem Venezuela, tu publicación ha sido seleccionada para el soporte del programa @booming.
Felicitaciones!
Para aportar al crecimiento de la Comunidad Steem Venezuela puedes delegar a nuestra Cuenta, haz Clic a los siguientes enlaces:
50 SP 100 SP 250 SP 500 SP 1000 SP
2500 SP
Muchas gracias @edili24!!! es un placer ser parte, saludos!