09-03-2025 - Education - redox reactions [EN]-[IT]

Cover background image generated with AI, software used: copilot microsoft
~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
[ENGLISH]
09-03-2025 - Education - redox reactions [EN]-[IT]
With this post I would like to provide some brief notions regarding the technical topic mentioned in the subject.
The context in which we operate is that of chemistry
(code notes: MOD-83)
Redox reactions
Have you ever heard of redox reactions? This is a little-known term, but each of us has had to deal with oxidation problems, perhaps on door handles, on the bodywork of the car... well, the topic we are dealing with today is a chemistry topic that is related precisely to these phenomena.
Let's start...
Redox reactions are also called redox reactions and are chemical processes in which a transfer of electrons occurs between two substances.
Before continuing, let's clarify the concept of oxidation and oxidation numbers:
Oxidation
In chemistry, oxidation is a reaction during which a substance loses electrons. This reaction is accompanied by the addition of oxygen or the removal of hydrogen from the substance in question.
Oxidation numbers
Oxidation numbers are values attributed to atoms in a molecule or compound. They are intended to keep track of how electrons are distributed among atoms. Essentially, the oxidation number represents the formal charge of an atom if the electrons of the bonds were assigned entirely to the more electronegative element.
NOTE: Atoms in the elementary state, i.e. non-bonded atoms, or single atoms, have an oxidation number equal to zero (such as O₂, Fe, etc.).
Oxidation numbers are very important for balancing redox reactions.
Balancing oxidation-reduction reactions
Balancing oxidation-reduction reactions is the procedure used to make chemical reactions congruent in which both a loss of electrons and an acquisition of electrons occur simultaneously, i.e. an oxidation and a reduction occur simultaneously.
The study of balancing redox reactions is performed to ensure that the atoms and electrical charges are balanced on both sides of the chemical equation.
These balancings are performed for two important principles:
-Conservation of mass
-Conservation of charge
example of balancing a redox reaction
Let's take an example of balancing a redox reaction in an acidic environment.
Let's examine the reaction between potassium permanganate and iron (II) sulfate, in simplified ionic form.
MnO4- + Fe^2+ ---> Mn^2+ Fe^3+
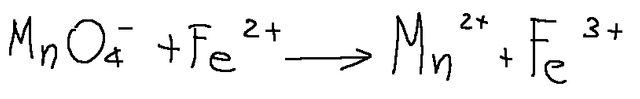
The procedures we will have to carry out are:
-Identification of half-reactions. The two half-reactions are oxidation and reduction
-Balancing the reduction half-reaction
-Balancing the oxidation half-reaction
-Equalize the number of electrons
-Sum of the two half-reactions
-Interpretation in molecular form
At the end of all these processes we will obtain the final balanced equation (in net ionic form)
MnO4- + 8H+ 5Fe^2 ---> Mn^2+ + 4H2O + 5 Fe^3+
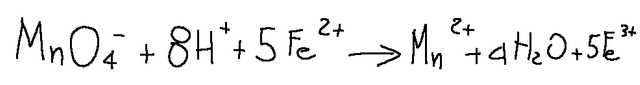
Conclusions
Balancing the redox reactions ensures that both mass and charge are conserved.
Where:
Mass = the same number of atoms of each element in the reactants and products
Charge = same total number of electrons, i.e. same algebraic sum of charges
Question
Have you ever tried to balance an oxidation-reduction reaction?

[ITALIAN]
09-03-2025 - Education - reazioni di ossidoriduzione [EN]-[IT]
Con questo post vorrei fornire alcune brevi nozioni a riguardo dell’argomento tecnico citato in oggetto.
Il contesto in cui operiamo è quello della chimica
(code notes: MOD-83)
Reazioni di ossidoriduzione
Avete mai sentito parlare di reazioni redox? Questo è un termine poco noto, però ognuno di noi ha avuto a che fare con problemi di ossidazione, magari alle maniglie delle porte, alla carrozzeria della macchina.. ebbene, l'argomento che trattiamo oggi è un argomento di chimica che è relativo proprio a questi fenomeni.
Partiamo...
Le reazioni di ossidoriduzione vengono chiamate anche reazioni redox e sono processi chimici in cui avviene un trasferimento di elettroni tra due sostanze.
Prima di proseguire chiariamo il concetto di ossidazione e numeri di ossidazione:
Ossidazione
In chimica l'ossidazione è una reazione durante la quale una sostanza perde elettroni. Questa reazione si accompagna all'aggiunta di ossigeno o alla rimozione di idrogeno dalla sostanza in questione.
Numeri di ossidazione
I numeri di ossidazione sono valori attribuiti agli atomi in una molecola o in un composto. Essi hanno lo scopo di tenere traccia di come gli elettroni sono distribuiti tra gli atomi. Sostanzialmente il numero di ossidazione rappresenta la carica formale di un atomo se gli elettroni dei legami fossero assegnati interamente all'elemento più elettronegativo.
NOTA: Gli atomi allo stato elementare, cioè atomi non legati, ovvero singoli atomi, hanno numero di ossidazione uguale a zero (tipo O₂, Fe, ecc.).
I numeri di ossidazione sono importantissimi per bilanciare reazioni redox.
Bilanciamento reazioni di ossidoriduzione
Il bilanciamento delle reazioni di ossidoriduzione è la procedura con cui si rendono congruenti le reazioni chimiche in cui avviene contemporaneamente sia una perdita di elettroniche un acquisizione di elettroni, ovvero che avviene contemporaneamente un'ossidazione e una riduzione.
Lo studio del bilanciamento delle reazioni di ossidoriduzione viene eseguito per far sì che gli atomi e le cariche elettriche risultino bilanciati su entrambi i lati dell’equazione chimica.
Questi bilanciamenti vengono eseguito per due principi importanti:
-Conservazione della massa
-Conservazione della carica
esempio di bilanciamento di una reazione di ossidoriduzione
Facciamo un esempio di un bilanciamento di una reazione di ossidoriduzione in ambiente acido.
Esaminiamo la reazione tra permanganato di potassio e solfato di ferro (II), in forma ionica semplificata.
MnO4- + Fe^2+ ---> Mn^2+ Fe^3+
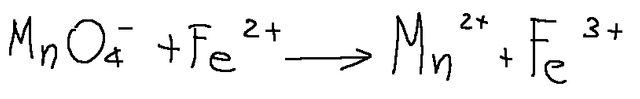
Le procedure che dovremo eseguire sono:
-Individuazione delle semireazioni. Le due semireazioni sono l'ossidazione e la riduzione
-Bilanciamento della semireazione di riduzione
-Bilanciamento della semireazione di ossidazione
-Uniformare il numero di elettroni
-Somma delle due semireazioni
-Interpretazione nella forma molecolare
Alla fine di tutti questi processi otterremo l'equazione finale bilanciata (in forma ionica netta)
MnO4- + 8H+ 5Fe^2 ---> Mn^2+ + 4H2O + 5 Fe^3+
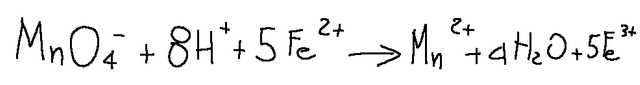
Conclusioni
Il bilanciamento delle reazioni di ossidoriduzione garantisce che siano conservati sia la massa, sia la carica.
Dove:
La massa = lo stesso numero di atomi di ciascun elemento nei reagenti e nei prodotti
La carica = stesso numero totale di elettroni, ossia stessa somma algebrica delle cariche
Domanda
Avete mai provato a fare un bilanciamento di una reazioni di ossidoriduzione?
THE END
Upvoted! Thank you for supporting witness @jswit.
This post has been upvoted by @italygame witness curation trail
If you like our work and want to support us, please consider to approve our witness
Come and visit Italy Community